 面非対称化 面非対称化 オレフィンやケトンは 及び 及び *軌道を有している。両軌道は構成原子を含む平面に関して対称な広がりをもち、かつ位相関係が異なる。この対称平面を *軌道を有している。両軌道は構成原子を含む平面に関して対称な広がりをもち、かつ位相関係が異なる。この対称平面を 面といい、非対称分子では 面といい、非対称分子では 面が非対称化し、試薬の選択性を生じる。 面が非対称化し、試薬の選択性を生じる。 面選択性は 面選択性は 面非対称化が原子や原子団の大きさの違いである立体効果(古典的立体効果)の存在しない場合にも現れる。 面非対称化が原子や原子団の大きさの違いである立体効果(古典的立体効果)の存在しない場合にも現れる。 分子全体のHOMOもしくは、LUMOは軌道相互作用の原理に従って構築できる。オレフィン分子全体のHOMOはエチレンの 軌道をもとに残りの部分構造の被占軌道を逆位相(out-of-phase)で組み合わせることで得られ、これが求電子試薬との反応に関わる。ケトン分子全体のLUMOはカルボニルの 軌道をもとに残りの部分構造の被占軌道を逆位相(out-of-phase)で組み合わせることで得られ、これが求電子試薬との反応に関わる。ケトン分子全体のLUMOはカルボニルの *軌道をもとに残りの部分構造の空軌道を同位相(in-phase)で組み合わせることで得られ、求核試薬との反応に関わる。 *軌道をもとに残りの部分構造の空軌道を同位相(in-phase)で組み合わせることで得られ、求核試薬との反応に関わる。 置換ビシクロオレフィン類の 面選択性 面選択性 大和田らは電子求引性基を有するビシクロオクテン類(A類)の求電子試薬に対する 面選択性がsyn優先性であることを示した。また、電子求引性基を有するメチレンノルボルナン類(B類)もsyn優先性である。 面選択性がsyn優先性であることを示した。また、電子求引性基を有するメチレンノルボルナン類(B類)もsyn優先性である。  - - 軌道相互作用 軌道相互作用 両系(A、B)の面選択性を支配している要因はオレフィン 軌道とこれに重なりの最も大きいビシナル 軌道とこれに重なりの最も大きいビシナル c-c軌道との間の相互作用であることが大和田らによって示された。つまり、置換基が電子求引性基の場合、これに隣接するビシナル c-c軌道との間の相互作用であることが大和田らによって示された。つまり、置換基が電子求引性基の場合、これに隣接するビシナル c-c軌道のエネルギー準位が低下し、この部分のビシナル c-c軌道のエネルギー準位が低下し、この部分のビシナル c-c軌道とオレフィン c-c軌道とオレフィン 軌道との相互作用が減少する。その結果、分子全体のHOMOに対する寄与が置換基側で減少し、求電子試薬はよりout-of-phase性の小さいsyn側から優先的に攻撃したと説明できる(Figure 1)。 軌道との相互作用が減少する。その結果、分子全体のHOMOに対する寄与が置換基側で減少し、求電子試薬はよりout-of-phase性の小さいsyn側から優先的に攻撃したと説明できる(Figure 1)。 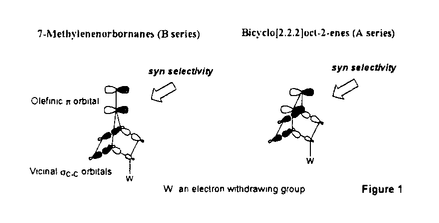 Figure 1 Figure 1 本研究では、A類に電子供与性基を導入し、上述した一般則が成り立つことを確認することから開始した。置換基が電子供与性基のメチルないしシクロブタンの場合には、選択性は低いが、anti優先性になる。また、B類でもanti優先性がMehtaらにより報告されており、A、B類ともに 面選択性は電子求引性基と逆となる。やはり電子供与性基の場合もビシナル 面選択性は電子求引性基と逆となる。やはり電子供与性基の場合もビシナル c-c軌道が関与し、電子求引性基に対応する機構で説明できる。すなわち、置換基に隣接するビシナル c-c軌道が関与し、電子求引性基に対応する機構で説明できる。すなわち、置換基に隣接するビシナル c-c軌道のエネルギー準位が上昇し、この部分のビシナル c-c軌道のエネルギー準位が上昇し、この部分のビシナル c-c軌道とオレフィン c-c軌道とオレフィン 軌道との相互作用が強まり、分子全体のHOMOに対する寄与が増す。求電子試薬はよりout-of-phase性の小さいanti側から優先的に攻撃したと説明できる(Figure 2)。 軌道との相互作用が強まり、分子全体のHOMOに対する寄与が増す。求電子試薬はよりout-of-phase性の小さいanti側から優先的に攻撃したと説明できる(Figure 2)。 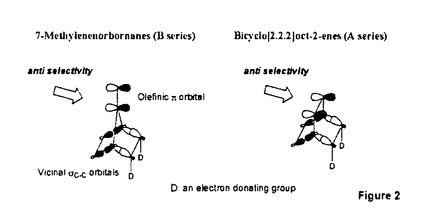 Figure 2シクロプロパン体に対する求電子反応 Figure 2シクロプロパン体に対する求電子反応 シクロプロパンは特定の立体配置において、オレフィン同等もしくは、それ以上の強い電子供与性基として知られており、このシクロプロパンをA類に導入することで、高いanti優先性が得られると考え、シクロプロパン環を有するトリシクロノネン類(C1-4)及びメチレントリシクロオクタン(D1)をデザイン、合成した。 C類及びD1に対して求電子試薬との反応を行った。C類は予測に反し、いずれの求電子試薬との反応においても極めて高いsyn優先性を示した。これに対し、D1はanti優先性を示した(Table 1).シクロプロパンは単なる電子供与性基として作用しているのではないとみられる。 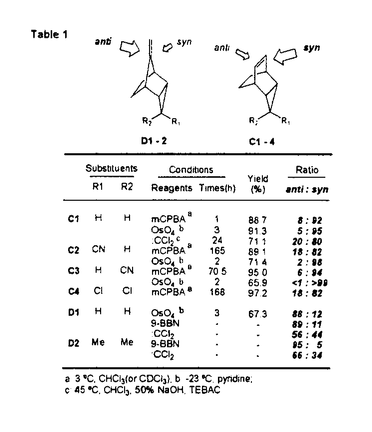 Table 1シクロプロパンWalsh軌道とオレフィン Table 1シクロプロパンWalsh軌道とオレフィン 軌道のout-of-phase性の軌道相互作用 軌道のout-of-phase性の軌道相互作用 シクロプロパンを電子供与性アルキル置換基と見なし、C類とD類の 面選択性の要因はオレフィン 面選択性の要因はオレフィン 軌道とビシナル 軌道とビシナル c-c軌道との c-c軌道との - - 軌道相互作用であると考えてみる(Figure 3)。A類とB類にシクロプロパンを導入すると、これに隣接するビシナル 軌道相互作用であると考えてみる(Figure 3)。A類とB類にシクロプロパンを導入すると、これに隣接するビシナル c-c軌道のエネルギーが上昇し、この部分でのオレフイン c-c軌道のエネルギーが上昇し、この部分でのオレフイン 軌道とのout-of-phase性の相互作用が増す。試薬がよりout-of-phase性の小さい側から攻撃すると考えると、D類のanti優先性は説明できるが、C類のsyn優先性を説明することができない。また、オレフィン 軌道とのout-of-phase性の相互作用が増す。試薬がよりout-of-phase性の小さい側から攻撃すると考えると、D類のanti優先性は説明できるが、C類のsyn優先性を説明することができない。また、オレフィン 軌道とWalsh軌道との相互作用が重要であると考えてみる(Figure 3)。しかし、どちらの系でも同じ相互作用を考えている以上、その逆の面選択性を説明することはできない。また、C1とD1のシクロプロパンのp性に着目し、より歪みの大きいD1ではシクロプロパンのp性が高いが、歪みの小さいC1ではp性が低いと考えても、out-of-phase性の相互作用をこの面でのみ考えている以上、求電子試薬はよりout-of-phase性の小さい側から攻撃すると考えれば、D類のanti優先性は説明できるが、C類のsyn優先性は説明できない。 軌道とWalsh軌道との相互作用が重要であると考えてみる(Figure 3)。しかし、どちらの系でも同じ相互作用を考えている以上、その逆の面選択性を説明することはできない。また、C1とD1のシクロプロパンのp性に着目し、より歪みの大きいD1ではシクロプロパンのp性が高いが、歪みの小さいC1ではp性が低いと考えても、out-of-phase性の相互作用をこの面でのみ考えている以上、求電子試薬はよりout-of-phase性の小さい側から攻撃すると考えれば、D類のanti優先性は説明できるが、C類のsyn優先性は説明できない。 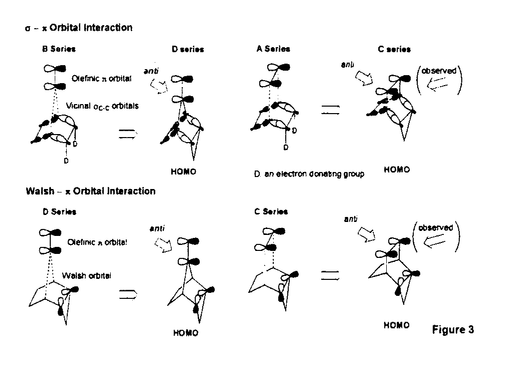 Figure 3 Figure 3 軌道の関与によるHOMOの逆転 軌道の関与によるHOMOの逆転 そこで、オレフィン 軌道とシクロプロパンWalsh軌道のout-of-phase性の相互作用でできる軌道とin-phase性の軌道に対する 軌道とシクロプロパンWalsh軌道のout-of-phase性の相互作用でできる軌道とin-phase性の軌道に対する 軌道の寄与について考察した。C1において、オレフィン 軌道の寄与について考察した。C1において、オレフィン 軌道(h)とシクロプロパンWalsh軌道(i)のin-phase性の相互作用でできる軌道(k)のエネルギー準位は 軌道(h)とシクロプロパンWalsh軌道(i)のin-phase性の相互作用でできる軌道(k)のエネルギー準位は 軌道(n)に近づく。さらに、nはkと対称性も一致することから、これらが相互作用してできた軌道(1)のエネルキー準位は大きく上昇する。この結果、1のエネルギー準位はhとiのout-of-phase性の軌道(m)よりも高くなり、分子全体のHOMOとなると考えることができる(Scheme 1)。 軌道(n)に近づく。さらに、nはkと対称性も一致することから、これらが相互作用してできた軌道(1)のエネルキー準位は大きく上昇する。この結果、1のエネルギー準位はhとiのout-of-phase性の軌道(m)よりも高くなり、分子全体のHOMOとなると考えることができる(Scheme 1)。 一方、D1におけるオレフィン 軌道(a)とシクロプロパンWalsh軌道(b)はC1に比べエネルギー的に近接しており、強く相互作用している。これはD1のシクロプロパンのp性がC1よりも高いためと考えられる。したがって、aとbのout-of-phase性の軌道(c)のエネルギー準位はaとbのin-phase性の軌道(d)に 軌道(a)とシクロプロパンWalsh軌道(b)はC1に比べエネルギー的に近接しており、強く相互作用している。これはD1のシクロプロパンのp性がC1よりも高いためと考えられる。したがって、aとbのout-of-phase性の軌道(c)のエネルギー準位はaとbのin-phase性の軌道(d)に 軌道(g)がout-of-phase性で相互作用した軌道(f)のエネルギー準位よりも高く、分子全体のHOMO(e)になっていると考えられる(Scheme 1)。 軌道(g)がout-of-phase性で相互作用した軌道(f)のエネルギー準位よりも高く、分子全体のHOMO(e)になっていると考えられる(Scheme 1)。 以上により、C類とD類の面選択性の逆転は種類の異なるHOMOによって説明できることがわかった。 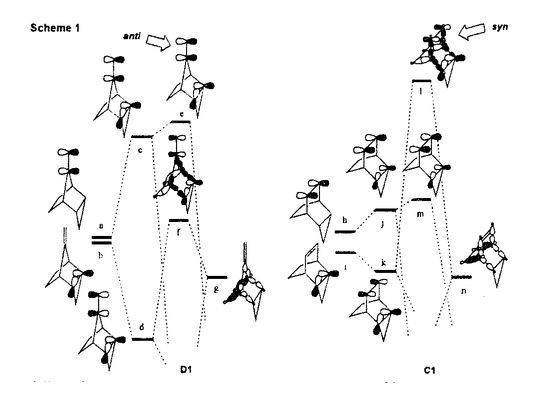 Scheme 1幾何学的要因に基づく軌道相互作用 Scheme 1幾何学的要因に基づく軌道相互作用 C類における軌道の準位の逆転はビシクロオクテン系では本来、幾何学的な理由あるいは、他の理由から本質的と考えられる。そこで、この理論を検証するために、C類のシクロプロパンのp性を極端に高めた例としてビシクロジエンのモデル系における二つのオレフィン 軌道の相互作用について実験と理論的考察を試みた。 軌道の相互作用について実験と理論的考察を試みた。 ビシクロオクタジエン(E2)及びビシクロノナジエン(E3)の求電子試薬との反応は圧倒的なsyn優先性を示した。一方、ノルボルナジエン(E1)の求電子試薬に対する 面選択性はanti優先性である(Table 2)。 面選択性はanti優先性である(Table 2)。 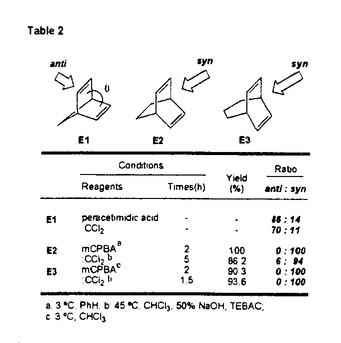 Table 2 Table 2 これら非共役二重結合を有するビシクロジエンの 面選択性を説明するために、非共役二重結合を含む平面の二面角( 面選択性を説明するために、非共役二重結合を含む平面の二面角(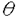 )を導入した。二つのオレフィン )を導入した。二つのオレフィン 軌道が 軌道が 軌道と有効に相互作用するためには二面角( 軌道と有効に相互作用するためには二面角(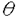 )がある角度を越えなければならない。つまり、 )がある角度を越えなければならない。つまり、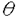 が小さいE1(115.6°)の場合、 が小さいE1(115.6°)の場合、 軌道同士の相互作用が効果的に現れるが、 軌道同士の相互作用が効果的に現れるが、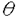 が大きいE2(123.4°)やE3の場合にはこの相互作用は小さく、 が大きいE2(123.4°)やE3の場合にはこの相互作用は小さく、 軌道との相互作用が有効になると考えることができる。この 軌道との相互作用が有効になると考えることができる。この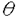 に依存したHOMOの逆転はシクロヘキサジエン(E5)を例にとって示すことができる(Figure 4)。E5の に依存したHOMOの逆転はシクロヘキサジエン(E5)を例にとって示すことができる(Figure 4)。E5の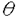 を変化させると、 を変化させると、 が130°付近でHOMOとNextHOMO(NHOMO)の逆転が起こる。つまり、B1対称軌道とA1対称軌道は が130°付近でHOMOとNextHOMO(NHOMO)の逆転が起こる。つまり、B1対称軌道とA1対称軌道は に依存してHOMOもしくは、NHOMOになる。ただし、E5の二つのオレフィン に依存してHOMOもしくは、NHOMOになる。ただし、E5の二つのオレフィン 軌道の間に介在する 軌道の間に介在する 軌道はC-H 軌道はC-H 軌道であり、ビシクロジェンのC-C 軌道であり、ビシクロジェンのC-C 軌道よりも明らかにエネルギー準位が低い。言い換えると、二つのオレフィン 軌道よりも明らかにエネルギー準位が低い。言い換えると、二つのオレフィン 軌道のin-phase性の相互作用でできた軌道はC-H 軌道のin-phase性の相互作用でできた軌道はC-H 軌道のエネルギー準位よりもC-C 軌道のエネルギー準位よりもC-C 軌道により近く、これと強く相互作用するので、ビシクロジエンでは130°よりも小さい二面角でこの逆転が起こると考えられる。 軌道により近く、これと強く相互作用するので、ビシクロジエンでは130°よりも小さい二面角でこの逆転が起こると考えられる。 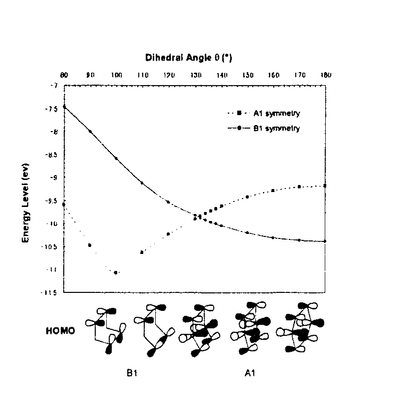 図表 図表 一方、Dのモデルであるメチレンノルボルネン(F1)においてもHOMOとNHOMOの逆転が起こる。単純にはF1の (128°)は計算上の逆転角よりやや大きく、二つのオレフィン (128°)は計算上の逆転角よりやや大きく、二つのオレフィン 軌道の相互作用はボーダーライン上にあると考えられる。しかしながら、この系は三中心二電子の芳香族性を有していることから、二つのオレフィン 軌道の相互作用はボーダーライン上にあると考えられる。しかしながら、この系は三中心二電子の芳香族性を有していることから、二つのオレフィン 軌道の相互作用はむしろ大きいと考えられる(Figure 5)。 軌道の相互作用はむしろ大きいと考えられる(Figure 5)。 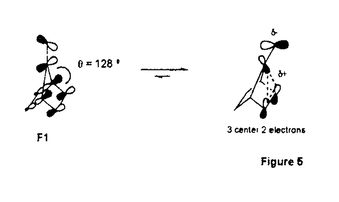 Figure 5 Figure 5 以上により、E2とE3の面選択性とE1の面選択性の逆転は種類の異なるHOMO(HOMO-A1、HOMO-B1)によって説明できることがわかった(Figure 6)。E1、E2及びE3における面選択性は古典的立体効果で説明が不可能ではないが、CとDの系で有効であった理論がここでも有効なのである。 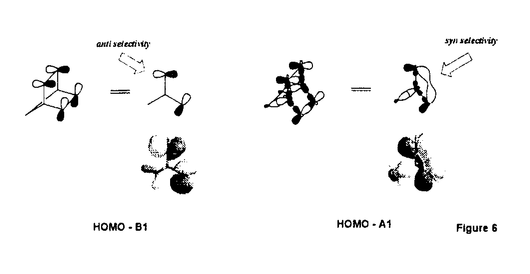 Figure 6 Figure 6 オレフィンに対する求電子試薬の攻撃はオレフィンから求電子試薬への電子の摂動(非局在化)過程である。HOMO-A1はジエン側で二つのオレフィン 軌道がin-phase性の相互作用を採っているので、ジエン側のHOMOの電子密度は高い。つまり、高い摂動能力を有している。空の軌道を有する求電子試薬がこの空間に接近すると、同位相の軌道に電子の非局在化が起こる。一方、HOMO-B1はジエン側で二つのオレフィン 軌道がin-phase性の相互作用を採っているので、ジエン側のHOMOの電子密度は高い。つまり、高い摂動能力を有している。空の軌道を有する求電子試薬がこの空間に接近すると、同位相の軌道に電子の非局在化が起こる。一方、HOMO-B1はジエン側で二つのオレフィン 軌道がout-of-phase性の相互作用を採っているので、求電子試薬がこの空間に接近すると、一方の 軌道がout-of-phase性の相互作用を採っているので、求電子試薬がこの空間に接近すると、一方の 軌道の位相ともう一方の 軌道の位相ともう一方の 軌道の位相による打ち消しの干渉によって電子の摂動は起こりにくい。したがって、求電子試薬は電子の摂動範囲のより大きいanti側から接近することになる。シクロプロパン誘導体C、Dでもこの考え方で反応の面選択性を決定できる。 軌道の位相による打ち消しの干渉によって電子の摂動は起こりにくい。したがって、求電子試薬は電子の摂動範囲のより大きいanti側から接近することになる。シクロプロパン誘導体C、Dでもこの考え方で反応の面選択性を決定できる。 結論 以上私は、シクロプロパンを有するビシクロオレフィン及び、その近似的な等価体と考えられる非共役ビシクロジエンにおいて、幾何学的要因によって性質の異なる軌道がHOMOになり、そのHOMOがオレフィンの面選択性を決定していることを見いだした。モノオレフィンばかりでなく、ビシクロジエンの系においても軌道相互作用によって統一的に面選択性を説明することに成功した。 |