社会の高齢化による脳梗塞とともに自動車交通事故などによる外傷性脳損傷の増加が今後予想され、これら疾患における救命率の向上や後遺症の軽減化を目的とする急性期治療の確立が求められている。本研究では脳梗塞と外傷性脳損傷に共通する病態要因である脳浮腫に注目し、死亡率により薬効評価が可能な片側脳浮腫モデルの作製を試みた。そこで、Na+/K+ATPase活性やエネルギー代謝を障害し細胞障害性脳浮腫を誘発するトリエチル錫(TET)に着目した。本実験ではTETの脳内投与により重度の浮腫を誘発し、これに起因する二次的虚血によるグルタミン酸放出を想定した。はじめに本モデルの特性を明らかとするため、TETの投与量と死亡率及び脳水分含量の関係、脳内部位別水分含量、TET投与6時間後の病理組織、脳水分含量のタイムコース及びin vivoマイクロダイアリシス法による大脳皮質グルタミン酸濃度につき検討を行った。そののち死亡率と脳水分含量あるいは神経症状をパラメータとし、N-methyl-D-aspartate(NMDA)受容体非競合的拮抗薬のMK-801と同競合的拮抗薬のD-CPP-ene、並びに抗脳浮腫薬のグリセロールの持続的静脈内投与法による後処置効果を検討した。D-CPP-eneの実験ではその治療有効時間に関しても検討した。 TETは右内頚動脈へ0.2mg/minの速度で脳内へ注入した。MK-801(0.01,0.03mg/h)、D-CPP-ene(0.1,0.3mg/h)及びグリセロール(150mg/h)はTET2mg注入終了直後、内頚静脈より6時間持続投与した。D-CPP-eneの治療有効時間の実験では、TET投与終了の1時間あるいは2時間後より同薬物の投与を開始した。本研究では、内頚動静脈へ向けたカニュレーション手術とマイクロダイアリシス用ガイドカニューラの固定手術以外はすべて無麻酔無拘束下で実施した。 図1にTET(1.25-10mg)投与48時間以内の死亡率(A)と右大脳半球水分含量(B)を示した。死亡率と脳水分含量は共にTET1.25-5.0mgの用量範囲で直線的に増加した。この事はTETの投与量により、死亡率が20%から100%の範囲で設定可能である事を示している。TET2.5mgを投与した時の大脳皮質、線条体、海馬及び脳幹の水分含量は無処置対照群と比較しいずれも著明に増加した。組織標本より、注入側大脳皮質では核濃縮を伴う神経細胞のshrinkage及び神経細胞やアストロサイト近傍の空胞化など浮腫変性が、また視床では著明な空胞化変性が観察された。これらの結果は脳浮腫がTET注入側の白質のみならず、灰白質にも形成された事を示している。脳水分含量のタイムコースの実験より、TET2mgの投与後2時間から少なくとも8時間まで、右半球の水分含量の有意な増加が観察された(図2)。大脳皮質の細胞外グルタミン酸濃度はTET投与直後一過性に上昇し、2時間より上昇が再開、その後少なくとも10時間まで基礎レベルの2-3倍の濃度が継続した(図3)。これは細胞外グルタミン酸濃度の維持機能の低下を反映していると思われた。以上の結果、TET投与2時間以降ではグルタミン酸と脳浮腫が相互に影響しながら病態を悪化させ、それら障害の集積がある水準を越えると死に至ると考えられた(図7)。 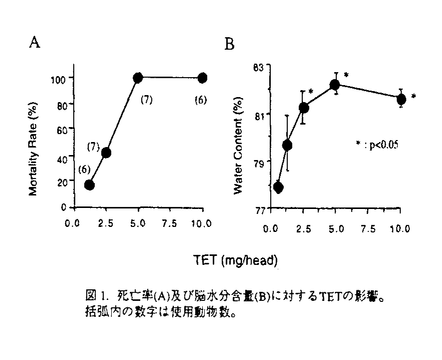 図1.死亡率(A)及び脳水分含量(B)に対するTETの影響。括弧内の数字は使用動物数。 図1.死亡率(A)及び脳水分含量(B)に対するTETの影響。括弧内の数字は使用動物数。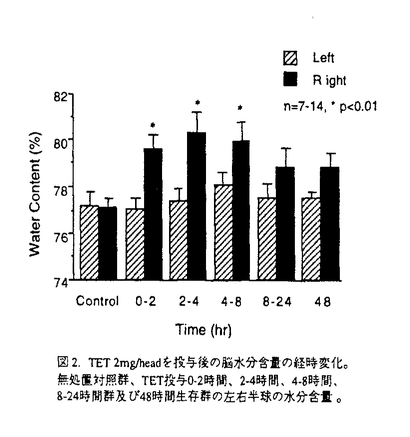 図2.TET2mg/headを投与後の脳水分含量の経時変化。無処置対照群、TET投与0-2時間、2-4時間、4-8時間、8-24時間群及び48時間生存群の左右半球の水分含量。 図2.TET2mg/headを投与後の脳水分含量の経時変化。無処置対照群、TET投与0-2時間、2-4時間、4-8時間、8-24時間群及び48時間生存群の左右半球の水分含量。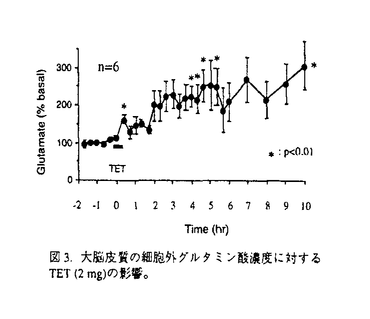 図3.大脳皮質の細胞外グルタミン酸濃度に対するTET(2mg)の影響。 図3.大脳皮質の細胞外グルタミン酸濃度に対するTET(2mg)の影響。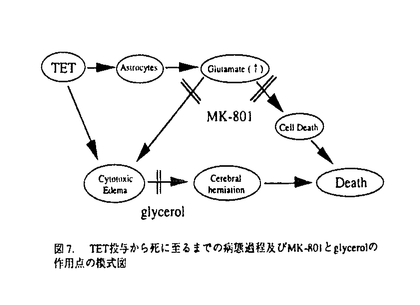 図7. TET投与から死に至るまでの病態過程及びMK-801とglycerolの作用点の模式図 図7. TET投与から死に至るまでの病態過程及びMK-801とglycerolの作用点の模式図 そこでTET(2mg)を注入した直後よりMK-801、D-CPP-ene及びグリセロールを6時間投与し(iv infusion)、それらの効果を検討した。MK-801は死亡率と脳水分含量の増加を有意に改善し(図4-A,B)、特に0.03mg/h×6h投与群の動物は全例生存した(図4-A)。D-CPP-eneもこれと同様用量依存的な改善効果が見られ、0.3mg/h×6h投与群で死亡率は有意に低下した(図5)。脳水分含量の有意な改善及び神経症状の改善傾向も0.3mg/h×6h投与群で認められた。グリセロール150mg/h×6hは死亡率(図5)と脳水分含量に対し改善傾向を示すにとどまり、NMDA受容体拮抗薬と比較するとその効力は弱かった。MK-801(0.03mg/h×6h)とD-CPP-ene(0.3mg/h×6h)は直腸体温を降下させなかった事から、これら薬物の改善効果に体温降下が関与する可能性は低い。 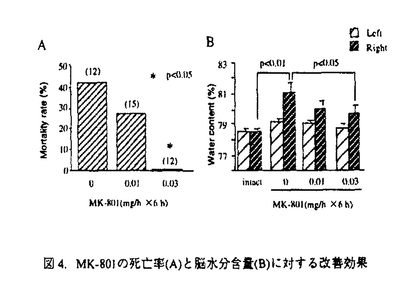 図4.MK-801の死亡率(A)と脳水分含量(B)に対する改善効果 図4.MK-801の死亡率(A)と脳水分含量(B)に対する改善効果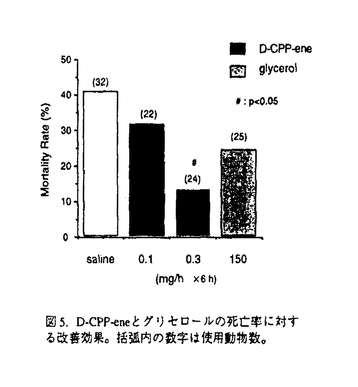 図5.D-CPP-eneとグリセロールの死亡率に対する改善効果。括弧内の数字は使用動物数。 図5.D-CPP-eneとグリセロールの死亡率に対する改善効果。括弧内の数字は使用動物数。 次にD-CPP-eneの治療有効時間を検討した。D-CPP-ene(0.3mg/h×6h)の1時間遅延投与群では脳水分含量に対する改善効果は消失したが(図6-B)、死亡率に対する効果は維持された(図6-A)。2時間後投与群では死亡率、脳水分含量増加に対する改善効果はともに消失した。 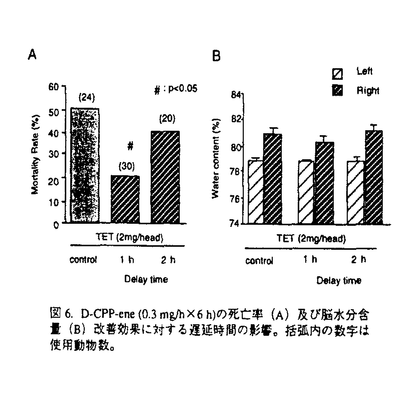 図6.D-CPP-ene(0.3mg/h×6h)の死亡率(A)及び脳水分含量(B)改善効果に対する遅延時間の影響。括弧内の数字は使用動物数。 図6.D-CPP-ene(0.3mg/h×6h)の死亡率(A)及び脳水分含量(B)改善効果に対する遅延時間の影響。括弧内の数字は使用動物数。 TETを内頚動脈より注入する事で死亡率が一定水準に設定できるラット片側脳浮腫モデルを作製した。このTET誘発脳浮腫モデルは、注入側半球の白質ばかりでなく灰白質にも重度の浮腫を誘発した。またTET投与2時間以後のグルタミン酸濃度の継続的上昇は、細胞外グルタミン酸濃度の維持機能の低下を反映していると思われる。この様な特徴的なグルタミン酸濃度上昇は脳虚血によるそれよりも、むしろ外傷性脳損傷患者の脳内あるいは脳脊髄液中グルタミン酸濃度の変動に類似していた。この点で本モデルは、外傷性脳損傷の病態特性を有する動物モデルと考えられた。本モデルではTET投与から2時間以内の浮腫はTETに起因するが、2時間以降の浮腫形成ではTETとともにグルタミン酸も関与している可能性が考えられた。実際,MK-801の投与により死亡率と脳浮腫が有意に改善された事は、TET投与から死に至る過程でNMDA受容体を介する細胞のswelling誘発作用や神経細胞死が重要な役割を果たしている可能性を示唆する(図7)。D-CPP-eneの薬効を検討したところ、MK-801と同様、死亡率と脳水分含量増加を有意に抑制し、神経症状に対しても改善傾向を示した。これらの事より、本モデルは死亡率や脳水分含量あるいは神経症状をパラメータとしてNMDA受容体拮抗薬の薬効評価系として応用可能と考えられた。 TET注入1時間後よりD-CPP-eneの投与を開始した時、死亡率は有意に改善されたが、2時間後の場合ではその改善効果は消失した。この事から本モデルにおけるD-CPP-eneの治療有効時間は1時間と推測された。この実験より、外傷性脳損傷の臨床試験においてD-CPP-eneの脳内濃度がNMDA受容体をブロックする水準に達し、かつそれが一定時間継続されたとしても、その治療成績は障害発生からD-CPP-eneの投与開始までの時間間隔に依存する可能性が示唆された。 |