近年、癌細胞と転移先の微小環境との相互作用が、臓器特異的転移に大きな影響を与えていることが明らかとされてきているが、骨転移については、多くが未解明の状態である。本研究は、骨転移機構における癌細胞と骨関連細胞との細胞間相互作用の果たす役割について検討を加え、以下の成果を得た。 (1)溶骨性骨転移細胞の骨吸収活性および骨転移像:臨床において高頻度に溶骨性骨転移を起こすヒト乳癌細胞(H-31細胞、MDA-MB-231細胞)および骨転移モデル系にて溶骨性骨転移を示すことが明らかとされているヒトメラノーマ細胞(A375M細胞)の培養上清を用い、骨において転移巣を形成するために重要と考えられる骨吸収活性について検討を行った。その結果、いずれの細胞もマウス頭頂骨からのCa遊離作用を示し、その頭頂骨には明瞭な破骨細胞(TRAP染色陽性細胞)と破骨細胞に取り囲まれた骨吸収像が観察された。また、in vivo骨転移像においても、癌細胞と接する骨組織は厚みが減少し、癌細胞と骨の間には破骨細胞が多数認められた。これらのことから、これら癌細胞は、破骨細胞を利用して骨吸収を引き起こすことにより自らの増殖の場を確保し、骨転移巣を形成していることが示唆された。 (2)類骨層破壊に関わる癌細胞-骨芽細胞間相互作用:破骨細胞は、骨表面に類骨層が存在した状態では骨基質の吸収ができず、その類骨層の破壊には、骨芽細胞の産生するtype Iコラゲナーゼが重要な役割を果たしている可能性が示唆されてきている。そこで、ヒト乳癌H-31細胞とヒト骨芽細胞様細胞MG63細胞のtype Iコラゲナーゼ産生における相互作用について検討を行った。その結果、H-31細胞由来の液性因子がMG63細胞のtype Iコラゲナーゼ産生を促進していることが明らかとなった。この結果は、癌細胞としてMDA-MB-231細胞、骨芽細胞としてマウス骨芽細胞MC3T3-E1細胞を用いた場合にも同様に認められた。この骨芽細胞の産生するtype Iコラゲナーゼは、マトリックスメタロプロテアーゼであるMMP-1であることが明らかにされた。また、骨器官培養系において、H-31細胞培養上清による骨吸収作用は、MMPのinhibitorであるminocyclinにより抑制された。H-31細胞およびMDA-MB-231細胞はコラーゲンに対して走化性を示すことも明らかとなった。これらの事実は、骨髄腔に侵入した溶骨性癌細胞は、骨芽細胞からのMMP-1産生を促進し類骨層の分解を引き起こすことにより、破骨細胞による骨吸収を促進させるとともに、その結果、分解・遊離したコラーゲンへの走化性を示し、骨基質内へ浸潤していく可能性が示された。 (3)破骨細胞の形成に関わる癌細胞-骨芽細胞間相互作用:in vivo骨転移像および骨器官培養系において、癌細胞による破骨細胞の出現が観察されたため、破骨細胞の形成における癌細胞の関与について検討を行なった。その結果、いずれの癌細胞培養上清も、骨芽細胞様細胞Saos-2細胞からの破骨細胞形成因子であるIL-11産生を顕著に増加させた。Saos-2細胞単独の培養上清は、骨吸収活性測定系においてCa遊離作用を示さなかったが、A375M細胞培養上清で処理したSaos-2細胞の培養上清は、A375M細胞培養上清と比較しても有為な骨吸収活性を示し、その活性は抗IL-11中和抗体によって阻害された。癌細胞におけるIL-11産生誘導因子の産生について、RT-PCR法を用い検討した結果、IL-1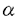 ,TGF- ,TGF- 1,M-CSFおよびPTHrPのmRNA発現が認められたが、癌細胞培養上清によるIL-11産生促進は、抗TGF- 1,M-CSFおよびPTHrPのmRNA発現が認められたが、癌細胞培養上清によるIL-11産生促進は、抗TGF- 中和抗体のみが阻害活性を示した。このことより、癌細胞の産生するTGF- 中和抗体のみが阻害活性を示した。このことより、癌細胞の産生するTGF- 1が骨芽細胞からのIL-11産生を促進している可能性が示唆されたが、A375M細胞培養上清中には活性型及び潜在型TGF- 1が骨芽細胞からのIL-11産生を促進している可能性が示唆されたが、A375M細胞培養上清中には活性型及び潜在型TGF- 活性は認められず、Saos-2細胞が潜在型TGF- 活性は認められず、Saos-2細胞が潜在型TGF- を産生していることが明らかとなった。また、Saos-2細胞をA375M細胞培養上清で処理した培養液中に活性型TGF- を産生していることが明らかとなった。また、Saos-2細胞をA375M細胞培養上清で処理した培養液中に活性型TGF- が出現した。これらの結果より、これら癌細胞は、骨芽細胞の産生する潜在型TGF- が出現した。これらの結果より、これら癌細胞は、骨芽細胞の産生する潜在型TGF- を活性化することにより、骨芽細胞からのIL-11産生を誘導し、破骨細胞の形成を促進することにより溶骨反応を引き起こしている可能性が示された。 を活性化することにより、骨芽細胞からのIL-11産生を誘導し、破骨細胞の形成を促進することにより溶骨反応を引き起こしている可能性が示された。 以上、本研究は溶骨性骨転移腫瘍と骨関連細胞との細胞間相互作用について検討を行ない、骨芽・破骨細胞といった特殊な細胞が存在する骨においても、それらを利用した癌細胞の転移巣形成促進機構が存在する可能性を明らかとしたものであり、また骨転移を抑える薬剤の開発に示唆を与えるものであり、博士(薬学)の学位に値すると判定した。 |