糖尿病に対する遺伝子治療の方法として、インスリン遺伝子を導入した体細胞を移植する方法が考えられる。遺伝子導入細胞として、肝臓細胞はいくつかの利点を有すると考えられる。まず、肝臓は糖代謝の中枢臓器であり、インスリンの主要な標的臓器である。肝臓細胞へのインスリン遺伝子導入は他臓器への導入に比べより効率的であると考えられる。次に、生体からの肝臓細胞採取・体外遺伝子導入・再移植は現実に可能であることが、家族性高コレステロール血症に対する遺伝子治療治験で示されている。更に、膵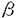 細胞はグルコース代謝経路を通してグルコース濃度を検知していると考えられているが、肝臓細胞と膵 細胞はグルコース代謝経路を通してグルコース濃度を検知していると考えられているが、肝臓細胞と膵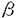 細胞とはグルコース代謝経路の多くのステップを共有している。肝臓細胞も何らかのグルコース濃度検知機構を有しているのではないかと推測され、これはグルコース濃度によりコントロールされるインスリン遺伝子の発現、分泌を目指す上で有利な点となりうる。我々は、肝臓由来の培養細胞系を確立し、この細胞にインスリン遺伝子を導入し、インスリン放出について検討した。 細胞とはグルコース代謝経路の多くのステップを共有している。肝臓細胞も何らかのグルコース濃度検知機構を有しているのではないかと推測され、これはグルコース濃度によりコントロールされるインスリン遺伝子の発現、分泌を目指す上で有利な点となりうる。我々は、肝臓由来の培養細胞系を確立し、この細胞にインスリン遺伝子を導入し、インスリン放出について検討した。 肝細胞としての分化機能を保持し,かつ試験管内での扱いが容易な培養細胞系を樹立するために、D-galactosamine投与による劇症肝炎の回復期に出現する肝実質前駆細胞を分離した。3〜6週令のC57/BL6マウスにD-galactosamineを5000mg/kg腹腔内投与し、2日後の肝臓からパーコールを用いて非実質細胞を分離して培養を開始した。無血清培地で4週間培養し、クッパー細胞や血管内皮細胞を除去して得られた細胞系は、アルブミン、トランスフェリンを産生し、G-6-Pase活性を有することから、成熟肝細胞の機能を保持していると考えられた。この細胞系は一年にわたり安定して継代培養可能であり、この間アルブミン、トランスフェリン、G-6-Pase活性は安定して発現していた。この細胞系を肝細胞のモデルとして以下の遺伝子導入実験を行った。 ラットのインスリン1遺伝子のcoding regionをCMVプロモーター下流においた導入遺伝子を作製し、これを肝臓細胞系にリン酸カルシウム法を用いて導入した。G418による選択と、培養上清中のIRI測定によるスクリーニングで、比較的高濃度のIRIを放出するクローン、43-15を選択し、これを用いて以下のIRI放出実験を行った。 43-15の培養上清中に認められたIRIの分子量は正常のインスリンよりも大きく、これは肝細胞がホルモンプロセッシング酵素であるPC1/2を持っていないため、プロインスリンがそのまま放出されるためと考えられた。 培養上清中のIRIは時間とともに増加し、培地のグルコース濃度が高いほどIRI濃度も上昇した。43-15のIRI放出は周囲のグルコース濃度に対する反応性を有すると考えられた。(なお、異なるグルコース濃度の各培地はマンニトールにより同一の浸透圧に調整されているので、グルコース濃度上昇による単なる浸透圧上昇の影響は除外されている。) 解糖系阻害剤である2-deoxyglucoseを培地に添加すると各グルコース濃度においてIRI放出は有意に抑制された。グルコースによるIRI放出促進効果は細胞内の解糖系以下のグルコース代謝を介して発揮されていると考えられた。 インスリン遺伝子のmRNAレベルはグルコース濃度の変化によらず一定であった。インスリン遺伝子はCMVプロモータの下流に置かれており、その発現は構成的である一方で、IRI放出のグルコースに対する反応性が遺伝子転写以降の段階で行われていることが示された。 膵臓ランゲルハンス島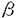 細胞においてグルコースセンサーとして機能していると考えられているGLUT2,glucokinaseはともにこの細胞系では発現していなかった。GLUT2を欠くことから、GLUT1など他のグルコース輸送体によるグルコース輸送がIRI放出のグルコース反応性に関わっていることが示唆された。また、グルコース代謝系の中でglucokinase以外のステップが関与していることも示唆された。 細胞においてグルコースセンサーとして機能していると考えられているGLUT2,glucokinaseはともにこの細胞系では発現していなかった。GLUT2を欠くことから、GLUT1など他のグルコース輸送体によるグルコース輸送がIRI放出のグルコース反応性に関わっていることが示唆された。また、グルコース代謝系の中でglucokinase以外のステップが関与していることも示唆された。 インスリン遺伝子導入細胞をC57/BL6マウスの肝臓に移植して60日後の肝臓の組織学的観察では、対照マウスでは認められないインスリン陽性細胞が認められ、移植細胞の腫瘍化は認められなかった。in vitroでは増殖を続ける43-15が生体内では増殖を止め、むしろ分化傾向に誘導されることと、CMVプロモータが生体内でも機能していることが示された。 以上の実験結果の成果は主に2点あると思われる。一つは、成熟肝細胞の機能を保持したまま増殖する細胞系を樹立したことであり、更にもう一つは、そのような肝細胞機能を保持した細胞にインスリン遺伝子を導入した場合のインスリン放出がグルコースに反応することを示した点である。 成熟肝細胞は細胞培養条件下では十分な増殖能を持たず、そのままでは細胞系とすることは困難であるとされている。肝細胞の細胞系を得るための方法として、肝腫瘍由来組織を用いたり、正常肝細胞へのoncogeneの導入が試みられているが、増殖能と正常肝機能保持は多くの場合背反的であり、これらをともに保持する細胞系の樹立は必ずしも容易ではない。今回の実験では、D-galactosamine投与後の激症肝炎の回復期に小型の肝実質前駆細胞が出現し、これが徐々に成熟肝細胞に分化して行くことに注目した。比重法によりこの小型細胞を分離し、無血清培地での培養により混入したクッパー細胞や血管内皮細胞を除去することにより、増殖能と正常肝機能をある程度ともに保持した細胞系を得ることが出来た。出発点である小型肝実質前駆細胞の、増殖しつつ分化するという性質が功を奏したものと思われる。肝臓内に移植された場合腫瘍化することなく増殖を停止することも肝細胞のモデルとして有用な性質であると思われる。 このような肝細胞系にインスリン遺伝子を導入したところ、グルコース反応性インスリン分泌を認めた。糖尿病に対する遺伝子治療としてインスリン遺伝子導入体細胞移植の動物実験が早くから試みられてきたが、従来はインスリン放出がグルコース濃度のコントロールを受けていないため、血糖が降下してもインスリン分泌が抑制されず、低血糖のために動物が死亡してしまう、という大きな問題点があった。グルコース濃度に反応してインスリンを放出する細胞を移植することができれば、遺伝子治療実用化へ向けての一つの進歩と言うことが出来る。今回の実験成績は、肝細胞の持つ代謝機能がグルコース反応性インスリン放出を可能にすることを強く示唆している。肝臓への生体内インスリン遺伝子導入の報告はいくつかあるが、今回我々は正常肝機能を保持したまま増殖能を持ち、in vitroでの検討が容易な細胞系を得たことで、インスリン放出がグルコースに反応することを初めて示すことが出来た。肝細胞と膵ランゲルハンス島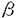 細胞ではグルコース濃度検知機構は必ずしも同一ではないと思われるが、グルコース代謝経路を通じて検知している点は共通であると思われる。膵ランゲルハンス島 細胞ではグルコース濃度検知機構は必ずしも同一ではないと思われるが、グルコース代謝経路を通じて検知している点は共通であると思われる。膵ランゲルハンス島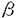 細胞において、代謝経路を通じてのグルコース濃度検知から蛋白放出に至るメカニズムは糖尿病の発症機序を解明する上で重要とされているが、依然不明な点が多く残されている。膵ランゲルハンス島 細胞において、代謝経路を通じてのグルコース濃度検知から蛋白放出に至るメカニズムは糖尿病の発症機序を解明する上で重要とされているが、依然不明な点が多く残されている。膵ランゲルハンス島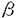 細胞に比較して取り扱いの容易な肝細胞のグルコース濃度検知機構を検討することで、膵ランゲルハンス島 細胞に比較して取り扱いの容易な肝細胞のグルコース濃度検知機構を検討することで、膵ランゲルハンス島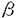 細胞についての理解も深まる事が期待される。 細胞についての理解も深まる事が期待される。 今回の研究では、インスリン放出のグルコース反応性と、肝臓内への移植生着を示したが、糖尿病実験動物に対する実際の治療効果を持たせるにはなおいくつかの課題がある。第一に、前述したように肝細胞はPC1/2を欠くため、放出されるIRIはプロインスリンのままである。プロインスリンの生理活性はプロセスされたインスリンに比べ劣るので、このままでは治療効率が悪い。この問題に対しては、肝細胞でもプロセスされるように改変された変異インスリン遺伝子を導入する方法や、PC1/2を導入する方法が考えられる。第二に、今回の43-15のインスリン放出率は膵ランゲルハンス島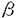 細胞の数十分の一であり、これもまた改良すべき点であるが、導入遺伝子のプロモータや遺伝子導入法を検討することにより改良は可能であると思われる。 細胞の数十分の一であり、これもまた改良すべき点であるが、導入遺伝子のプロモータや遺伝子導入法を検討することにより改良は可能であると思われる。 以上まとめると、D-galactosamine投与後のマウス肝臓から分離した、肝機能を保持した細胞系にインスリン遺伝子を導入し、そのインスリン放出がグルコース濃度に反応することを示した。肝細胞はグルコース代謝経路を通じてグルコース濃度を検知していると考えられた。このような肝細胞の特性は、将来の糖尿病遺伝子治療の対象細胞としての肝細胞の有用性を示すとともに、膵ランゲルハンス島 細胞のグルコース検知機構を解明する上からも参考となると思われる。 細胞のグルコース検知機構を解明する上からも参考となると思われる。 |