チューブリンは微小管を構成する単位タンパク質であり、真核生物に普遍的に存在する。それぞれ分子量5万の 、 、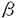 の二つのサブユニットから成るヘテロダイマーが単位となっている。有糸分裂が始まると、紡錘体の骨格をなす微小管の形成がおこる。紡錘体は不安定で、チューブリンに結合してその重合を妨げる薬剤によって顕著な影響を受ける。これらの薬剤を分裂中の細胞に作用させると細胞の有糸分裂が停止するのでこれらの化合物を有糸分裂阻害剤と呼ぶ。抗ガン剤開発の一方向としていかに効果的に細胞の分裂を停止させることが出来るかが重要な研究課題の一つになっている。 の二つのサブユニットから成るヘテロダイマーが単位となっている。有糸分裂が始まると、紡錘体の骨格をなす微小管の形成がおこる。紡錘体は不安定で、チューブリンに結合してその重合を妨げる薬剤によって顕著な影響を受ける。これらの薬剤を分裂中の細胞に作用させると細胞の有糸分裂が停止するのでこれらの化合物を有糸分裂阻害剤と呼ぶ。抗ガン剤開発の一方向としていかに効果的に細胞の分裂を停止させることが出来るかが重要な研究課題の一つになっている。 チューブリンに作用する化合物は現在までにいくつか知られている。そうした薬剤の代表的なものが共に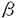 チューブリンに結合して重合を妨げるコルヒチンとビンブラスチンであるが、これらの作用部位は異なり、それぞれコルヒチン部位、ビンブラスチン部位と呼ばれている。ビンブラスチン部位結合化合物としては、ビンブラスチン、メイタンシン、リゾキシン等があるが結合部位の相互関係は当研究室にてこれまで詳細に検討され、相互の結合部位は完全には一致しないことが明らかとなっている。。リゾキシンは動物、植物、微生物等に強い活性を示す有糸分裂阻害剤で優れた抗腫瘍活性を示し強い抗真菌活性を有する。A.nidulansは人工的に耐性株を作成し得るが、耐性株ではいずれも100番目のアミノ酸がアスパラギンからイソロイシンに変異していた。更に、もともとリゾキシン耐性の野生型酵母[S.pombe,S.cervisiae]の100番目のアミノ酸をアスパラギンに変えるとリゾキシン感受性となり、天然に存在する酵母のリゾキシン耐性が チューブリンに結合して重合を妨げるコルヒチンとビンブラスチンであるが、これらの作用部位は異なり、それぞれコルヒチン部位、ビンブラスチン部位と呼ばれている。ビンブラスチン部位結合化合物としては、ビンブラスチン、メイタンシン、リゾキシン等があるが結合部位の相互関係は当研究室にてこれまで詳細に検討され、相互の結合部位は完全には一致しないことが明らかとなっている。。リゾキシンは動物、植物、微生物等に強い活性を示す有糸分裂阻害剤で優れた抗腫瘍活性を示し強い抗真菌活性を有する。A.nidulansは人工的に耐性株を作成し得るが、耐性株ではいずれも100番目のアミノ酸がアスパラギンからイソロイシンに変異していた。更に、もともとリゾキシン耐性の野生型酵母[S.pombe,S.cervisiae]の100番目のアミノ酸をアスパラギンに変えるとリゾキシン感受性となり、天然に存在する酵母のリゾキシン耐性が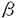 チューブリンの100番目のアミノ酸によって決定されていることを証明した。 チューブリンの100番目のアミノ酸によって決定されていることを証明した。 これまでに微小管の形成を制御し、様々な生物活性を引き起こす化合物が多数発見され、また合成されてきた。それらは制ガン剤、抗カビ剤、駆虫剤、除草剤など幅広く用いられている。これらの有糸分裂阻害剤の標的タンパクはいままで知られている限りではほとんどが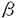 チューブリンである。チューブリンの一次構造は生物種間での相同性が高いにも関わらず、実際には阻害剤の作用には種特異性がある。このようなチューブリンの機能を解明し分子認識機構を明らかにすることが新しい薬剤の開発にもつながるものと考える。そのための研究手法として、1)新規有糸分裂阻害剤の探索、2)リガンド-チューブリンの相互作用の解析、3)活性発現に必要な構造単位の解析、4)天然化合物をリードとする新規な薬物の設計などが挙げられる。 チューブリンである。チューブリンの一次構造は生物種間での相同性が高いにも関わらず、実際には阻害剤の作用には種特異性がある。このようなチューブリンの機能を解明し分子認識機構を明らかにすることが新しい薬剤の開発にもつながるものと考える。そのための研究手法として、1)新規有糸分裂阻害剤の探索、2)リガンド-チューブリンの相互作用の解析、3)活性発現に必要な構造単位の解析、4)天然化合物をリードとする新規な薬物の設計などが挙げられる。 稲こうじ病はUstilaginoidea virensの感染により発病する、古くから農家によく知られている病害で、発病すると籾の収量が健全なイネに比べて非常に少なくなる。稲こうじの毒性については混入した飼料での牛などの中毒もしばしば発生したようである。 本研究者は稲こうじの水抽出液がイネ種子の発芽を著しく阻害し、正常に伸長せず丸く膨らむ現象を引き起こす現象に着目した。この現象はリゾキシンの活性に類似するものであり、稲こうじにもチューブリン作用物質が含まれると期待した。 これまでの稲こうじ成分の研究として、稲こうじの熱水抽出液が家兎に強い毒性を示すことが報告されている。また稲こうじの色素であるウスチラギノイジンA〜Jが知られているが、これらの色素は稲こうじの毒性には無関係とされている。 そこで稲こうじの水抽出液が引き起こすイネ種子の発芽異常を指標として、活性物質の単離と構造決定を試み、ウスチロキシンA〜Fを単離し、質量分析、NMR、アミノ酸分析、元素分析、X線結晶解析などより、その構造を図1のように決定した。 ウスチロキシンAは3-ヒドロキシ-イソロイシン、バリン、N-メチルチロシン誘導体のトリペプチドがエーテル架橋により13員環を形成しており、側鎖としてグリシン、3-(1-ヒドロキシエチル)アラニンがスルホキシドを介して結合している構造であった。 ウスチロキシンBの構造はAとの質量分析、NMR、アミノ酸分析による比較から、ウスチロキシンAのバリンがアラニンになった構造と決定した。ウスチロキシンC、D、Fは質量分析、NMRの詳細な検討からウスチロキシンA、Bの側鎖が違う構造と決定した。 ウスチロキシンD、Fは微量成分で、構造、活性を確認するためにそれぞれウスチロキシンA、Bのスルホキシドを含む側鎖を切断する反応を確立し、ウスチロキシンD、Fに誘導した。 またウスチロキシンDは単離したウスチロキシン類のなかでも単純な構造をしており、しかも活性を維持していること、主生成物であるウスチロキシンAからの変換が可能であることから、構造活性相関を調べる上で重要な化合物であると考え、ウスチロキシンDを化学修飾し官能基と活性の関連を検討した。また構造活性相関を明らかにする目的で、当研究室の武藤、高橋等は類縁体の合成を行った。  図1 稲こうじより単離したウスチロキシン類、ウスチロキシン誘導体および合成ウスチロキシン類縁体の構造とチューブリン重合阻害活性(IC50値) 図1 稲こうじより単離したウスチロキシン類、ウスチロキシン誘導体および合成ウスチロキシン類縁体の構造とチューブリン重合阻害活性(IC50値) 前述の様にウスチロキシンはチューブリン作用物質であることが期待できる。単離したウスチロキシン類、化学修飾したウスチロキシン誘導体、及び合成したウスチロキシン類縁体のチューブリンに対する影響についてブタ脳より精製した微小管蛋白を用いて濁度法により検討した。 ウスチロキシンA〜Fはいずれも濃度依存的に重合阻害活性を示し、ウスチロキシンAのチューブリン重合阻害活性のIC50値は1 Mとこれ迄に得られているチューブリン重合阻害剤に比べて特に強い活性を示した。ウスチロキシンBはAより弱いもののかなり強い活性を保持している。側鎖の活性への寄与についてはウスチロキシンAからDへの変換では活性がかなり保持されているにも関わらず、ウスチロキシンB、C、Fでは活性が順に低下している。 Mとこれ迄に得られているチューブリン重合阻害剤に比べて特に強い活性を示した。ウスチロキシンBはAより弱いもののかなり強い活性を保持している。側鎖の活性への寄与についてはウスチロキシンAからDへの変換では活性がかなり保持されているにも関わらず、ウスチロキシンB、C、Fでは活性が順に低下している。 また各種ウスチロキシンDの化学修飾体の活性評価より、14位の水酸基、9位のNメチル基は活性発現に重要な官能基であることが明らかとなった。また合成類縁体はいずれも活性は示さず、このことは2位および3位の官能基の重要性を示している。 ウスチロキシンは構造的には環状ペプチドで、古典的な有糸分裂阻害剤コルヒチン、ビンブラスチン又はリゾキシン等と異なりユニークな構造であった。 ペプチド系のチューブリン作用物質としてはこれまでにウスチロキシン類の他にフォモプシンA、ドラスタチン10などが天然物より単離報告されているが、これらの化合物については、当研究室においてチューブリンに対する作用の研究が進められており、いずれもビンブラスチン部位に結合する化合物であることが明かとなっている。ウスチロキシンとこれらの有糸分裂阻害剤の結合部位の関係を検討した。また、アレナスタチンはウスチロキシンとほぼ時を同じくして単離構造決定された新規ペプチド系化合物で、その強い細胞毒性が注目されるが、チューブリンに対する作用を検討した。 ウスチロキシンAのチューブリンへの結合部位については活性炭吸着法を用いた結合競合試験により解析した。ウスチロキシンAはリゾキシンのチューブリンへの結合を100%阻害する一方、フォモプシンのチューブリンへの結合を50%までしか阻害しない。リゾキシンもフォモプシンAのチューブリンへの結合を50%までしか阻害せず、ウスチロキシンAの結合部位がリゾキシンと同一であることを示した。スキャッチャード解析より結合部位はリゾキシンは一ケ所であるが、フォモプシンは二ケ所と推定され、この内high-affinity siteがリゾキシンの結合部位と一致することを示唆した。 次にアレナスタチンも、強いチューブリン重合阻害活性を示すことを確認した。結合部位については、ゲル濾過法により検討した結果、スキャッチャード解析より結合部位は1つで、各種チューブリン重合阻害剤との結合競合試験ではリゾキシンの結合を強く阻害し、リゾキシンと同じ結合部位に結合することが明らかとなった。 これらの化合物は、新しいタイプの有糸分裂阻害剤として一つの化合物群を形成しており、ペプチド系有糸分裂阻害剤と呼ぶこととした。 これらの化合物の各種生物活性試験の結果、チューブリン上でいずれもリゾキシン結合部位に結合するにも関わらず、生物活性においてはいくつかの種特異性を示しており、作用の多様性が明らかとなった。 |