学位論文要旨
| No | 213905 | |
| 著者(漢字) | 林,徳子 | |
| 著者(英字) | Hayashi,Noriko | |
| 著者(カナ) | ハヤシ,ノリコ | |
| 標題(和) | 酵素処理を用いたセルロースミクロフィブリルの形態および構造の解析 | |
| 標題(洋) | Morphological and Structural Analysis of Cellulose Microfibrils Using Enzymatic Treatment | |
| 報告番号 | 213905 | |
| 報告番号 | 乙13905 | |
| 学位授与日 | 1998.06.22 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 第13905号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 本論文は、天然セルロースを特異的に分解するセルラーゼという酵素を種々のセルロースに作用させ、穏和な加水分解を受けたセルロースミクロフィブリルの分解されにくい部分の構造を明らかにすることからセルロースミクロフィブリルの高次構造を明らかにしようとしたものであり、序章並びに7章から成る。実験に当たっては、残さを透過電子顕微鏡(TEM)観察、FTIR、X線回折および電子回折を用いて精査・分析した。セルロースミクロフィブリルは、その起源によって、サイズが異なったり、木化されていたり様々の環境にあるため、酵素加水分解残さについてはその比較検討が必要である。また、天然セルロースの結晶構造であるセルロースIに関する最近の研究から、海藻・バクテリアに多く含まれるI 第1章では、木材のセルロースミクロフィブリルについて検討した。広葉樹と針葉樹の形成層および分化中の細胞壁において、トリコデルマ・ビリデ由来のセルラーゼ(メイセラーゼ)に対する感受性の相違を調べた。樹木の形成層・分化帯では、セルロース・ヘミセルロースの堆積、リグニンの蓄積(木化)が進行する度合が各々の細胞によって異なるため、酵素加水分解の疎外要因である木化が様々な段階にあるときの酵素加水分解性を知ることができる。スギ、アカマツおよびシラカンバ、ブナの形成層を含んだ超薄切片をセルラーゼ溶液で40℃1時間処理し、処理前後の細胞壁の変化をTEMで追跡した。針葉樹仮道管壁では、木化が完了するとすぐに壁中のセルロースは加水分解されなくなったのに対し、広葉樹木繊維壁では、木化が完了後も壁中のセルロースは加水分解されたが、道管壁では木化の完了とともにセルロースの分解は阻止された。これは、針葉樹仮道管、広葉樹道管と広葉樹木繊維のリグニンの種類の違いによって縮合の仕様が異なり、そのため、セルロースミクロフィブリルのリグニンによる包埋状況が異なって、酵素分解性の差異が生じたと考えられる。 第2章では、針葉樹木部の細胞壁の難加水分解性が木化にあることに着目し、セルロースミクロフィブリルをあまり破壊せずにリグニンを細胞壁から除去する方法として、スギの木粉およびチップに水蒸気処理とオゾン処理を併用することを試みた。この方法によって、かなり効率的に細胞壁からリグニンを除去することができ、その部分はセルラーゼによってグルコースまで分解された。ただし、針葉樹には薄壁の早材仮道管と厚壁の晩材仮道管があり、この処理は早材には有効であったが、晩材仮道管では細胞壁全体に処理効果を浸透するには、80メッシュの木粉でもまだ大きく、水蒸気処理後解繊するなどさらに細胞壁を破壊する処理が必要であった。また、処理した試料とセルラーゼを反応させると、細胞壁の一部が白色物質として析出し、この部分は酵素加水分解が進まなかった。この白色物質は、密に凝集したセルロースミクロフィブリルから成っていた。 第3章では、酵素反応に対するセルロースミクロフィブリルの凝集の影響をアビセル、ホヤで検討することにした。アビセルでは精製処理により、また、ホヤでは生合成過程で、それぞれ、ミクロフィブリルの凝集の際立つ試料である。反応させるセルラーゼの量や、反応時間を変えて処理した結果、酵素はまず凝集した固まりの外側からセルロースミクロフィブリルを1本または数本ずつの束にほぐした後、順次分解を進めているように観察され、酵素は凝集したミクロフィブリルの水素結合をはずす働きも示した。 セルロースの起源の異なる場合、結晶の大きさや結晶系が異なる。第4章では、海藻・バクテリア型セルロースとコットン・ラミー型セルロースの2種類のセルロースの酵素加水分解性について検討した。海藻・バクテリア型セルロースに分類されるバクテリア、シオグサ、バロニアのセルロースおよび、コットン・ラミー型セルロースに分類されるアビセル(塩酸処理によりさらに精製した.)、綿リンターパルプ、ホヤのセルロース(ホヤはセルロースI 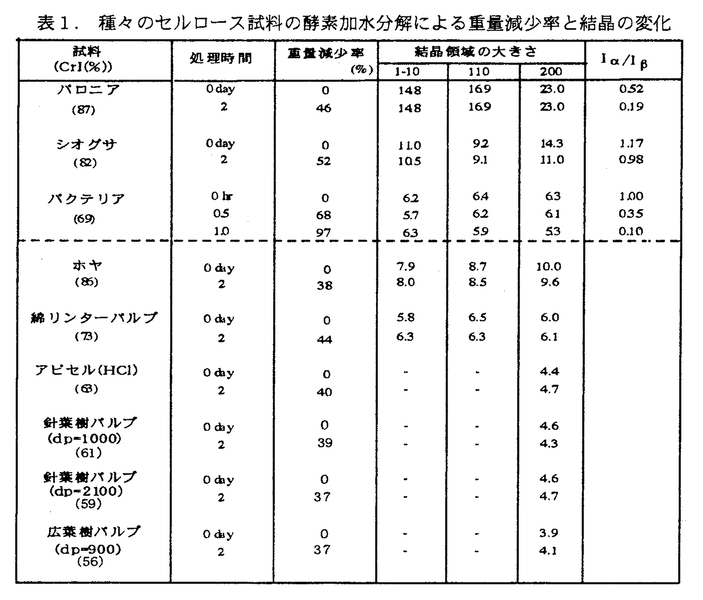 セルロースI 第5章では、シオグサとホヤのセルロース微結晶について酵素処理残さを調べた。シオグサとホヤのセルロース微結晶を酵素処理した結果、シオグサでは短繊維が産出され、ホヤでは部分的にフィブリル化したり、細くなったりするのが観察された。セルロースI 種々のセルロースミクロフィブリルの酵素加水分解残さをTEMで観察した結果、海藻・バクテリア型セルロースとコットン・ラミー型では残さの形態が異なり、酵素加水分解挙動が異なる可能性が示唆された。第6章では、シオグサセルロースで観察された長さの短いミクロフィブリルについて検討した。この短いミクロフィブリルの長さは、おおよそ300〜500nmに収束した。この短いミクロフィブリルは、電子回折ではスポット状の回折を与え、赤外吸収および電子回折による面間隔の帰属ではセルロースI 第7章では、ホヤセルロースの酵素加水分解残さで得られるフィブリル化したミクロフィブリルに焦点をあてた。ホヤセルロースを酵素処理すると、セルロースミクロフィブリルの幅が狭くなったり、あるいはさらに細いフィブリルに割れたりする場合が多く、さらにこれらがらせん状にねじれているような場合が観察された。このようなフィブリル化はセルロースI 本研究において、セルロースI | |
| 審査要旨 | 本論文は、天然セルロースを特異的に分解するセルラーゼを種々のセルロースに作用させ、それらの形態変化からセルロースミクロフィブリルの高次構造を明らかにしたものであり、序章及び7章から成る。 第1章では、針葉樹(スギ、アカマツ)と広葉樹(シラカンバ、ブナ)の形成層および分化中の細胞壁をTrichoderma viride由来のメイセラーゼで酵素分解した。その結果、針葉樹の仮道管壁では木化が完了するとセルロースは加水分解されなくなったのに対し、広葉樹では要素による差異が見られ、道管壁では木化の完了とともにセルロースの分解は阻止されたが、木繊維壁では木化が完了した後も分解が続くことを見出した。これは、それぞれの細胞壁中でリグニンによるセルロースミクロフィブリルの包埋状況がリグニンの縮合状態によって異なるためであると結論づけた 第2章では、水蒸気処理とオゾン処理を併用して脱リグニンを行ったスギの木粉およびチップがグルコースにまで加水分解されることを確認した。ただし、厚壁の晩材仮道管は水蒸気処理後解繊するなど、さらに細胞壁を破壊する処理が必要であった。他方、このような処理によっても、酵素加水分解に抵抗する白色物質が残り、それが密に凝集したセルロースミクロフイブリルから成っていることを見いだした。 第3章では、酵素に対するセルロースミクロフィブリルの凝集状態の影響をアビセル、ホヤセルロースで検討した結果、酵素はまず凝集した固まりの外側からセルロースミクロフイブリルを1本または数本の束にほぐした後、順次分解することを見出し、酵素が凝集したミクロフィブリル間の二次結合を切断する働きがあることを示した。 第4章では、セルロースI 第5章では、シオグサセルロースとホヤセルロースの微結晶の酵素処理残さを比較検討した結果、両者には違いがあり、シオグサでは短い繊維状になるのに対して、ホヤでは部分的にフィブリル化されることを見いだした。また種々のセルロースミクロフィブリルの酵素加水分解残さをTEMで観察した結果、海藻・バクテリア型セルロースとコットン・ラミー型では残さの形態が異なり、酵素加水分解挙動が異なることを明らかにした。 第6章では、シオグサセルロースの酵素加水分解で生じるミクロフイブリルの長さが、おおよそ300〜500nmに収束することを見出し、さらにこの短いミクロフィブリルがセルロースI 第7章では、ホヤセルロースの酵素加水分解で得られるフィブリル化したミクロフィブリルに焦点をあて、その特徴的な形態がコットン・ラミー型セルロースに特有な現象であり、高結晶性のサブフィブリルの存在を示唆するとした。 以上、本論文は天然セルロースを酵素分解することによってセルロースミクロフィブリルの形態に関する数多くの知見を与えたもので、学術上、応用上貢献するところが大である。よって審査員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50703 |
 型とコットン・ラミー等高等植物に多く含まれるI
型とコットン・ラミー等高等植物に多く含まれるI 型の2種類の結晶相の存在が明らかにされている。この2種類の結晶相と酵素加水分解性の関連にも注目した。木材中では、セルロースはリグニン、ヘミセルロースに包埋されているため、酵素加水分解が進まない。特に、広葉樹と針葉樹を比較すると、針葉樹ではセルロースが通常の処理では分解されないことが明らかにされている。どの程度リグニンによって包埋されたとき、酵素加水分解は不可能になるのか。また、セルロースミクロフィブリルは密に凝集した状態で観察されることが多いが、これは生合成の過程に生じたり、精製処理等により現われたりするので、酵素処理に際してはその影響を知っておく必要がある。
型の2種類の結晶相の存在が明らかにされている。この2種類の結晶相と酵素加水分解性の関連にも注目した。木材中では、セルロースはリグニン、ヘミセルロースに包埋されているため、酵素加水分解が進まない。特に、広葉樹と針葉樹を比較すると、針葉樹ではセルロースが通常の処理では分解されないことが明らかにされている。どの程度リグニンによって包埋されたとき、酵素加水分解は不可能になるのか。また、セルロースミクロフィブリルは密に凝集した状態で観察されることが多いが、これは生合成の過程に生じたり、精製処理等により現われたりするので、酵素処理に際してはその影響を知っておく必要がある。