1992年にArmitageらは、murine thymoma cell line EL4から、CD40との結合能を利用して、CD40 ligand(CD40L)のcDNAをクローニングし、その塩基配列からCD40LがType-II transmembrane型蛋白質であることを明らかにした。そして、同年murine CD40Lとのホモロジーを利用した方法でhuman CD40LのcDNAが単離された。 human CD40L cDNAがコードする蛋白質は、261個のアミノ酸からなり、その構造はN末端から、22個のアミノ酸で構成される細胞内ドメイン、24個のアミノ酸で構成される膜貫通ドメイン、そして、C末端までの一つのN-link glycosylation部位をもつ215個のアミノ酸で構成される細胞外ドメインから成っていた。human CD40Lは、murineとのホモロジーが極めて高く、TNF familyに属し、本遺伝子はX染色体q26.3-27.1に座位することも確認された。さらに、先天性免疫不全症の一つである伴性高IgM症候群患児では末梢血T細胞をPMA、Ca2+ionophoreで刺激した後もCD40抗体との結合能がなく、このことから本遺伝子上に変異があることが予想され、数グループにより本症の原因遺伝子であることが確認された。 また、CD40Lの機能はCD40と結合してB細胞の活性化を促し、その増殖やイムノグロブリンクラススイッチに中心的働きをすることが明らかとなった。そして、本遺伝子の変異による伴性高IgM症候群の臨床症状[i)正常あるいは高レベルのIgMと低レベルのIgG、IgA ii)好中球減少症 iii)T細胞の異常によって引き起こされるPneumocystis cariniiやCryptosporidiumに対する易感染性]はCD40Lの機能異常から推察される症状と良く一致していた。 本研究は、CD40Lの染色体DNA構造を明らかにし、本遺伝子の異常により引き起こされる伴性高IgM症候群の遺伝子診断を可能にすること、及び本遺伝子の上流領域の塩基配列を決定することにより調節機構の知見を得ることを目的に実施した。 伴性高IgM症候群の診断には、抗CD40抗体やmRNAを用いる方法があるものの、後述する様にその確定診断には種々の困難を伴うことが知られている。 CD40LゲノムDNAの単離 CD40LはT細胞を刺激することによりその発現が認められることから健常人リンパ球をPHAで刺激後、mRNAを抽出しKorthauerらの報告を基に設計したプライマーを用いてRT-PCRを行い、CD40Lの全コード領域を含むcDNAを得た。このcDNAをプローブとして健常人染色体DNAから作製したgenomic cosmid libraryをスクリーニングし、本領域を含むゲノミッククローンを3株得た。これらのクローンを解析し全コード領域を包含するクローンを選択した後、CD40L遺伝子を含む領域の制限酵素地図を作製した。次に、このクローンをサブクローニングし塩基配列の決定を行うことにより、エクソンの分布を調べた。その結果、本遺伝子は染色体上で約12kbの中に5つのエクソンに分かれて存在し、エクソン-イントロン結合領域は、総てAG/GTルールに従ったものであることが明らかになった。さらに、エクソンを挟む両側のイントロンについて塩基配列の情報を得るために、各エクソンを含むDNA断片の塩基配列を決定した。(この5つのエクソン近傍塩基配列をAccession No.D31793-31797として登録した。) CD40Lゲノム構造 胸腺RNAを用いた5’RACE法により本遺伝子の転写開始点を解析し、さらに開始コドンの約2kb上流の塩基配列とpoly A signalを含む3’非翻訳領域の塩基配列を決定した。 本領域には、典型的なTATA boxがなく、5’RACE法により決定した転写開始点に対して、-30領域にATに富む配列があり、また-135bp領域にはTATAATTの配列が存在した。CD22をはじめいくつかのリンパ系遺伝子の調節領域では、典型的なTATAboxが欠除していることが知られており、CD40Lも同様に典型的なTATA boxを欠き、-30領域のATに富む配列がプロモーターであると推察された。 一方、-135bp領域のTATAATT配列も典型的なTATAA(A/G)配列ではないものの、hsp70のプロモーター領域として知られているTATAA配列を含んでおり、この領域もプロモーターになる可能性が指摘されるが、本領域からの転写産物は得られなかったこと、及びマウスの相同領域との間で配列が保存されていないことから、その可能性は低いものと思われた。 また、NF-AT、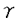 -IRE、NF-IL-6、NF-kB、CRE、GM-CSFなどのエンハンサー配列が存在し、本遺伝子が恒常的にではなく、外からの刺激により発現することと対応していた。さらに、5’調節領域をマウスCD40Lの相同領域と比較したところ80%以上のホモロジーを有していた。このことは、ヒトCD40Lがマウスと同様の制御を受けていることを示唆している。 -IRE、NF-IL-6、NF-kB、CRE、GM-CSFなどのエンハンサー配列が存在し、本遺伝子が恒常的にではなく、外からの刺激により発現することと対応していた。さらに、5’調節領域をマウスCD40Lの相同領域と比較したところ80%以上のホモロジーを有していた。このことは、ヒトCD40Lがマウスと同様の制御を受けていることを示唆している。 最後のエクソンの3’非翻訳領域には、polyadeniration signalが2ヶ所存在し、本遺伝子の転写産物が、ノーザンハイブリダイゼーションで約2kbと1.8kbの産物として得られていることと良く一致していた。さらに、本領域には、高度な多型性を示すCA repeatとC rich配列が存在した。 高IgM症候群の遺伝子診断 本研究により得られた塩基配列を基に、各エクソンに対してこれを挟むPCRプライマーを設計し、各エクソンとエクソン-イントロン結合領域を含む一部のイントロンをPCRにより増幅することを可能にした。また、遺伝子多型を調べる目的で健常人女性10名について各エクソンをPCR法で増幅し塩基配列を決定したところ、Hollenbaughらが報告しているコドン50のTTG/CTGのみが検出された。これらのことにより、ゲノムDNAからのPCR-SSCP法によるスクリーニング系と塩基配列の決定による高IgM症候群の遺伝子診断法を確立することができた。 臨床症状と解析結果 上記の研究を踏まえて、伴性高IgM血症が疑われる患児13名について、CD40L遺伝子の解析を行った。その結果、これら全て患児において本遺伝子上に変異点を見い出した。患児13名の変異は、4名がミスセンス変異、3名がナンセンス変異、3名がゲノム上の欠失、3名がスプライシング異常を引き起こす変異であった。また、ナンセンス変異1名とグノム上の欠失変異1名の患児母親を解析し、保因者であることを明らかにした。以下に1症例について詳述する。 患児は、1才時より口内炎を繰り返し、6才時に壊死性口内炎、中耳炎、不明熱、さらに好中球減少症により入院となった。入院時の血清グロブリンレベルは、IgG596mg/dl、IgA20mg/dl、IgM185mg/dlであり正常下限であった。以後も好中球減少、不明熱をくりかえし10才時に一過性ではあるが1300mg/dlを越すIgM高レベルを認めた為、伴性高IgM症候群を疑われたが確定診断には至らなかった。患児は、3週間ごとの グロブリン治療とG-CSF治療により健康を取り戻し外来通院となった。好中球数はG-CSF治療後、やや増加したが、月に一度500好中球/mm3に増加する程度で充分な増加は得られず、反復性の好中球減少症を示した。 グロブリン治療とG-CSF治療により健康を取り戻し外来通院となった。好中球数はG-CSF治療後、やや増加したが、月に一度500好中球/mm3に増加する程度で充分な増加は得られず、反復性の好中球減少症を示した。 患児及び患児母親末梢血よりDNAを抽出し、本研究で設計したPCRプライマーを用いて、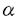 32P dCTPを加えた反応液でPCRを行いCD40Lの全てのエクソンを増幅した。各エクソン領域を含むPCR産物は、それぞれ351bp、262bp、183bp、210bp、452bpであり、これらRI標識したPCR産物を用いて、5%グリセロール含有5%ポリアクリルアミドゲルによるSSCP法で変異点の検索を行った。この際、エクソン5は、PCR産物のサイズが長すぎSSCP解析には不適切であるので、本領域に1ヶ所認識部位のある制限酵素HindIIIで消化した後、本解析を行った。その結果、患児および患児母親由来エクソン5のHindIII消化物の一方に電気泳動的移動度の差異を見出した。そこで、患児及び患児母親由来のエクソン5PCR産物をプラスミドpUC19に組込みクローン化し、塩基配列の決定を行ったところ、患児ではCodon212、213に対応する塩基配列CACAGTのCA部分2bpが欠失していた。さらに、患児母親は野性型と患児と同じ変異型の両アリルを有する保因者であることが判明した。また、患児末梢血細胞をPHAで刺激した後、抽出したRNAからRT-PCR法により得られた産物からも同様の変異を見出した。これらのことにより、本患児が保有する変異点はCodon212、213に跨るCAの欠失であると結論した。従って、患児由来CD40Lは2bp(CA)の欠失によりフレームシフトを起こし、変異点以降のアミノ酸配列が変化し、本変異点より52bp下流にStop Codonが新設されるものと考えられた。これによりN-link glycosylation部位も喪失しCD40Lの機能が失われたと推定できる。 32P dCTPを加えた反応液でPCRを行いCD40Lの全てのエクソンを増幅した。各エクソン領域を含むPCR産物は、それぞれ351bp、262bp、183bp、210bp、452bpであり、これらRI標識したPCR産物を用いて、5%グリセロール含有5%ポリアクリルアミドゲルによるSSCP法で変異点の検索を行った。この際、エクソン5は、PCR産物のサイズが長すぎSSCP解析には不適切であるので、本領域に1ヶ所認識部位のある制限酵素HindIIIで消化した後、本解析を行った。その結果、患児および患児母親由来エクソン5のHindIII消化物の一方に電気泳動的移動度の差異を見出した。そこで、患児及び患児母親由来のエクソン5PCR産物をプラスミドpUC19に組込みクローン化し、塩基配列の決定を行ったところ、患児ではCodon212、213に対応する塩基配列CACAGTのCA部分2bpが欠失していた。さらに、患児母親は野性型と患児と同じ変異型の両アリルを有する保因者であることが判明した。また、患児末梢血細胞をPHAで刺激した後、抽出したRNAからRT-PCR法により得られた産物からも同様の変異を見出した。これらのことにより、本患児が保有する変異点はCodon212、213に跨るCAの欠失であると結論した。従って、患児由来CD40Lは2bp(CA)の欠失によりフレームシフトを起こし、変異点以降のアミノ酸配列が変化し、本変異点より52bp下流にStop Codonが新設されるものと考えられた。これによりN-link glycosylation部位も喪失しCD40Lの機能が失われたと推定できる。 高IgM症候群の遺伝子診断の有用性 本研究によりCD40LのゲノムDNA構造が明らかになると共に、これを利用した高IgM症候群の遺伝子解析が可能となった。CD40Lの異常は前述の如く、抗CD40L抗体を用いたり、mRNAを用いて調べることも可能である。しかしながら、これらの方法は、本遺伝子が主に刺激されたT cellに発現することから、新鮮な細胞を採取する必要があり、且つ、細胞を刺激することも必要である。さらに、種々の免疫不全症においてCD40Lの発現低下が知られており、これらの方法では確定診断に至らない場合が多いことも明らかにされている。 本研究により確立されたゲノミックDNA用いる方法によれば、本症の確定診断のみならず、保因者診断、出生前診断さらに保存サンプルからの解析が可能となり、本症の診断に極めて有効であると考えられる。 |