| 内容要旨 | | ペプチドのアスパラギン残基に結合した糖鎖(Asn型)は、哺乳類の細胞表面で膜に結合して存在するタンパク質や体液中に分泌されたタンパク質の多くに見い出される。分泌タンパク質に結合した糖鎖は、タンパク質の生理活性の維持,抗原性の被覆,特定の器官へのターゲティング,血中からのクリアランスに関与している。一方細胞表面の糖タンパク質糖鎖は、発生,分化,免疫応答,腫瘍細胞の増殖や転移などの過程で見られる細胞と細胞あるいは細胞と細胞外マトリックスとの相互作用において、重要な役割を果たしていると考えられている。Asn型糖鎖やセリン/スレオニンに結合した糖鎖(ムチン型)に見られるGal 1→4GlcNAc 1→4GlcNAc 1→構造はN-アセチルグルコサミン転移酵素(GlcNAcT)と 1→構造はN-アセチルグルコサミン転移酵素(GlcNAcT)と -1,4-ガラクトース転移酵素( -1,4-ガラクトース転移酵素( -1,4-GalT)により作り出され、この構造上には様々な生理活性をもった糖鎖抗原が発現する。こうした糖鎖抗原の幾つかは組織形成に関与し、実際GlcNAcTIの遺伝子を破壊したマウスは、胎生期半ばで神経管や心血管系の形成不全により致死となることが報告されている。我々はAsn型糖鎖における -1,4-GalT)により作り出され、この構造上には様々な生理活性をもった糖鎖抗原が発現する。こうした糖鎖抗原の幾つかは組織形成に関与し、実際GlcNAcTIの遺伝子を破壊したマウスは、胎生期半ばで神経管や心血管系の形成不全により致死となることが報告されている。我々はAsn型糖鎖における -1,4-結合したガラクトース(Gal)の発現調節および固有の機能を解析するため、また -1,4-結合したガラクトース(Gal)の発現調節および固有の機能を解析するため、また -1,4-GalTが糖鎖の生合成のみならず細胞表面に存在し細胞接着分子として機能している可能性をより直接的に解析するため、 -1,4-GalTが糖鎖の生合成のみならず細胞表面に存在し細胞接着分子として機能している可能性をより直接的に解析するため、 -1,4-GalTの遺伝子を破壊したマウスを作製しそのマウスを解析することにより、明らかにしようと試みた。なお -1,4-GalTの遺伝子を破壊したマウスを作製しそのマウスを解析することにより、明らかにしようと試みた。なお -1,4-GalTノックアウトマウスは、東大医科研の浅野・岩倉両博士により作製された。 -1,4-GalTノックアウトマウスは、東大医科研の浅野・岩倉両博士により作製された。 1. -1,4-GalT欠損マウスの表現型の解析 -1,4-GalT欠損マウスの表現型の解析  -1,4-GalT欠損(GalT-/-)マウスは、2カ所の翻訳開始部位及びゴルジ体局在化シグナルを含むexon 1の大半をPGKneobpAで置換し、ES細胞に導入して作製された。GlcNAcTI欠損マウスと同様に胎生期で致死となることが予想されたが、このマウスはほぼメンデルの法則に従い生まれてきた。しかし、このマウスは離乳期までに約50%が、それから数カ月以内に残りの多くが死ぬという準致死の性質をもつことが判明した。各組織の切片を組織学的に解析したが、顕著な異常は見出されず、直接の死因は未だ不明である。GalT-/-マウスから生まれたマウスは対照のマウスに比べ小さく、明らかな成長遅延が認められた。また新生児では、皮膚上皮の顆粒細胞層と有棘細胞層でケラトヒアリン顆粒の増大を伴う過形成が見られ、また小腸上皮の陰窩で細胞増殖の亢進による肥厚が見られた。しかしこれらの異常は一過性であり、生後2〜3週で消失した。マウスの受精や胚発生の過程で、細胞表面の -1,4-GalT欠損(GalT-/-)マウスは、2カ所の翻訳開始部位及びゴルジ体局在化シグナルを含むexon 1の大半をPGKneobpAで置換し、ES細胞に導入して作製された。GlcNAcTI欠損マウスと同様に胎生期で致死となることが予想されたが、このマウスはほぼメンデルの法則に従い生まれてきた。しかし、このマウスは離乳期までに約50%が、それから数カ月以内に残りの多くが死ぬという準致死の性質をもつことが判明した。各組織の切片を組織学的に解析したが、顕著な異常は見出されず、直接の死因は未だ不明である。GalT-/-マウスから生まれたマウスは対照のマウスに比べ小さく、明らかな成長遅延が認められた。また新生児では、皮膚上皮の顆粒細胞層と有棘細胞層でケラトヒアリン顆粒の増大を伴う過形成が見られ、また小腸上皮の陰窩で細胞増殖の亢進による肥厚が見られた。しかしこれらの異常は一過性であり、生後2〜3週で消失した。マウスの受精や胚発生の過程で、細胞表面の -1,4-GalTや -1,4-GalTや -1,4-結合したGalを含むオリゴ糖が重要であると考えられてきたが、GalT-/-マウス同士の交配でも妊娠し、かつ子孫が生まれてくることから、再検討の余地がある。 -1,4-結合したGalを含むオリゴ糖が重要であると考えられてきたが、GalT-/-マウス同士の交配でも妊娠し、かつ子孫が生まれてくることから、再検討の余地がある。 2. -1,4-GalT欠損マウスの生化学的解析 -1,4-GalT欠損マウスの生化学的解析 対照マウスの肝臓を抗 -1,4-GalT抗体で免疫染色すると、ゴルジ体が存在する核周囲が点状に染色されたが、GalT-/-マウスでは染色されなかった。またGalT-/-マウス組織のノーザンブロット解析で -1,4-GalT抗体で免疫染色すると、ゴルジ体が存在する核周囲が点状に染色されたが、GalT-/-マウスでは染色されなかった。またGalT-/-マウス組織のノーザンブロット解析で -1,4-GalT mRNAは検出されず、この変異マウスでは -1,4-GalT mRNAは検出されず、この変異マウスでは -1,4-GalTは発現していないと判定された。しかしながらGalT-/-マウスの各組織のホモジェネートを酵素源とし -1,4-GalTは発現していないと判定された。しかしながらGalT-/-マウスの各組織のホモジェネートを酵素源とし -1,4-GalT活性を測定すると、肝臓や脾臓などの組織でGalT+/+マウスの比活性を100%とすると約10%の活性が存在した。GalT+/+マウスとGalT-/-マウスの肝臓のミクロソーム画分を可溶化し、ゲル濾過カラムで -1,4-GalT活性を測定すると、肝臓や脾臓などの組織でGalT+/+マウスの比活性を100%とすると約10%の活性が存在した。GalT+/+マウスとGalT-/-マウスの肝臓のミクロソーム画分を可溶化し、ゲル濾過カラムで -1,4-GalTを分画すると、GalT+/+マウスでは2つの活性ピークが、またGalT-/-マウスからはその1つに対応する活性ピークが得られ、分子量の異なる少なくても2つの -1,4-GalTを分画すると、GalT+/+マウスでは2つの活性ピークが、またGalT-/-マウスからはその1つに対応する活性ピークが得られ、分子量の異なる少なくても2つの -1,4-GalTが存在する可能性が示唆された。 -1,4-GalTが存在する可能性が示唆された。 3. -1,4-GalT欠損マウスの糖鎖構造の解析 -1,4-GalT欠損マウスの糖鎖構造の解析 GalT+/+マウスの10%に相当する酵素活性がGalT-/-マウスで糖鎖の生合成に関与しているかどうかを解析するため、血清と肝臓の糖タンパク質を用いてレクチンブロットで解析した。その結果、GalT-/-マウスでは弱いながらもRCA-I( -1,4-結合したGalに結合するレクチン)と反応するバンドが存在し、このバンドは肺炎双球菌由来の -1,4-結合したGalに結合するレクチン)と反応するバンドが存在し、このバンドは肺炎双球菌由来の -ガラクトシダーゼやN-グリカナーゼで消化するとレクチンと反応しなくなった。従ってGalT-/-マウスの糖タンパク質には、Gal -ガラクトシダーゼやN-グリカナーゼで消化するとレクチンと反応しなくなった。従ってGalT-/-マウスの糖タンパク質には、Gal 1→4GlcNAc 1→4GlcNAc 1→構造をもつAsn型糖鎖が存在することが示唆された。GalT-/-マウスの糖タンパク質をPVL( 1→構造をもつAsn型糖鎖が存在することが示唆された。GalT-/-マウスの糖タンパク質をPVL( -GlcNAcを認識するレクチン)と反応させると、対照に比較して強く反応する多数のバンドが検出され、糖鎖の多くがGlcNAcで停止していることが推定された。血清糖タンパク質からヒドラジン分解により糖鎖を遊離させその構造を解析し、レクチンブロットで得られた結果を確認した。その結果、GalT-/-マウスの血清糖タンパク質では、 -GlcNAcを認識するレクチン)と反応させると、対照に比較して強く反応する多数のバンドが検出され、糖鎖の多くがGlcNAcで停止していることが推定された。血清糖タンパク質からヒドラジン分解により糖鎖を遊離させその構造を解析し、レクチンブロットで得られた結果を確認した。その結果、GalT-/-マウスの血清糖タンパク質では、 -1,4-結合したGalをもつ糖鎖はGalT+/+マウスの10%ほど存在することが判明した。 -1,4-結合したGalをもつ糖鎖はGalT+/+マウスの10%ほど存在することが判明した。 4. -1,4-GalT欠損マウス脳の糖鎖抗原の解析: -1,4-GalT欠損マウス脳の糖鎖抗原の解析: ポリシアル酸は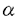 2→8結合でシアル酸が直鎖上に重合した構造で、主として神経細胞接着分子(N-CAM)のAsn型糖鎖に結合し、Neu5Ac 2→8結合でシアル酸が直鎖上に重合した構造で、主として神経細胞接着分子(N-CAM)のAsn型糖鎖に結合し、Neu5Ac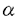 2→3Gal 2→3Gal 1→4GlcNAc 1→4GlcNAc 1→R構造上に発現している。また硫酸化グルクロン酸を抗原とするHNK-1抗原はGal 1→R構造上に発現している。また硫酸化グルクロン酸を抗原とするHNK-1抗原はGal 1→4GlcNAc 1→4GlcNAc 1→R構造上に発現し、ポリシアル酸と同様に神経細胞間の接着や神経細胞の軸索突起の形成や移動に関与している。いずれもGal 1→R構造上に発現し、ポリシアル酸と同様に神経細胞間の接着や神経細胞の軸索突起の形成や移動に関与している。いずれもGal 1→4GlcNAc 1→4GlcNAc 1→構造をもつ糖鎖に発現しているので、GalT-/-マウスではこれらの糖鎖抗原が消失し、神経組織形成に異常が見られると予想された。しかしながらGalT-/-マウスでは、行動異常や脳の組織学的構築に有意な変化が見られなかった。そこでGalT-/-マウス脳の糖タンパク質で、これらの糖鎖抗原の発現の有無をイムノブロットで解析した。その結果、GalT+/+マウスとGalT-/-マウスの糖タンパク質では、ポリシアル酸やHNK-1抗原の発現量や発生学的変化には有意な相違は見られず、これはGalT-/-マウス脳の糖タンパク質ではGal 1→構造をもつ糖鎖に発現しているので、GalT-/-マウスではこれらの糖鎖抗原が消失し、神経組織形成に異常が見られると予想された。しかしながらGalT-/-マウスでは、行動異常や脳の組織学的構築に有意な変化が見られなかった。そこでGalT-/-マウス脳の糖タンパク質で、これらの糖鎖抗原の発現の有無をイムノブロットで解析した。その結果、GalT+/+マウスとGalT-/-マウスの糖タンパク質では、ポリシアル酸やHNK-1抗原の発現量や発生学的変化には有意な相違は見られず、これはGalT-/-マウス脳の糖タンパク質ではGal 1→4GlcNAc 1→4GlcNAc 1→構造をもつ糖鎖が、GalT+/+マウスと同じように発現していることによることが、RCA-Iを用いたレクチンブロットにより判明した。GalT-/-マウス脳の 1→構造をもつ糖鎖が、GalT+/+マウスと同じように発現していることによることが、RCA-Iを用いたレクチンブロットにより判明した。GalT-/-マウス脳の -1,4-GalT酵素活性を調べるとGalT+/+マウスの65-70%の比活性が検出され、脳では別の -1,4-GalT酵素活性を調べるとGalT+/+マウスの65-70%の比活性が検出され、脳では別の -1,4-GalTがGal -1,4-GalTがGal 1→4GlcNAc 1→4GlcNAc 1→構造を作っていると考えられた。 1→構造を作っていると考えられた。 5. -1,4-GalT欠損マウス血清IgG糖鎖の構造解析: -1,4-GalT欠損マウス血清IgG糖鎖の構造解析: Asn型糖鎖に含まれる -1,4-結合したGalが関与する疾患として、慢性関節リウマチ(RA)が知られている。ヒト免疫グロブリンG(IgG)には、重鎖のCH2ドメインの297番目のAsnに複合型2本鎖構造のオリゴ糖が結合している。RA患者血清IgGは、健常ヒト血清IgGに較べてGalをもたない糖鎖が増加していることが知られている。この糖鎖異常はIgGにのみに起こり、IgAやトランスフェリンには見られず、この限定された糖鎖修飾の原因は未だ明らかではない。IgGの糖鎖からGalが減少する傾向は、結核やクローン病などの疾患でも認められている。しかしこのGalT-/-マウスでは、生後32週を生き延びたマウスでも関節炎やクローン病などが見られなかった。そこでGalT-/-マウスの血清IgG糖鎖のガラクトース含量を解析した結果、GalT+/+マウスでは血清IgG糖鎖の約70%が -1,4-結合したGalが関与する疾患として、慢性関節リウマチ(RA)が知られている。ヒト免疫グロブリンG(IgG)には、重鎖のCH2ドメインの297番目のAsnに複合型2本鎖構造のオリゴ糖が結合している。RA患者血清IgGは、健常ヒト血清IgGに較べてGalをもたない糖鎖が増加していることが知られている。この糖鎖異常はIgGにのみに起こり、IgAやトランスフェリンには見られず、この限定された糖鎖修飾の原因は未だ明らかではない。IgGの糖鎖からGalが減少する傾向は、結核やクローン病などの疾患でも認められている。しかしこのGalT-/-マウスでは、生後32週を生き延びたマウスでも関節炎やクローン病などが見られなかった。そこでGalT-/-マウスの血清IgG糖鎖のガラクトース含量を解析した結果、GalT+/+マウスでは血清IgG糖鎖の約70%が -1,4-結合したGalを持つのに対して、GalT-/-マウスでは約8%であった。血清IgG糖鎖のガラクトシル化のレベルと、RAの病態形成がどのように関連するか、さらに詳しい解析が必要である。 -1,4-結合したGalを持つのに対して、GalT-/-マウスでは約8%であった。血清IgG糖鎖のガラクトシル化のレベルと、RAの病態形成がどのように関連するか、さらに詳しい解析が必要である。  -1,4-GalTノックアウトマウスでは、予想していた細胞間接着の乱れから起こる器官形成異常や免疫応答の異常から起こる疾患は見出されなかった。また特定の組織で見られた異常な細胞増殖も、生後3週以内に消失した。また予想に反してGalT-/-マウスの糖タンパク質にはGal -1,4-GalTノックアウトマウスでは、予想していた細胞間接着の乱れから起こる器官形成異常や免疫応答の異常から起こる疾患は見出されなかった。また特定の組織で見られた異常な細胞増殖も、生後3週以内に消失した。また予想に反してGalT-/-マウスの糖タンパク質にはGal 1→4GlcNAc 1→4GlcNAc 1→構造をもつAsn型糖鎖が存在することが判明し、これは残存する新たな 1→構造をもつAsn型糖鎖が存在することが判明し、これは残存する新たな -1,4-GalT活性によるものと考えられた。これにより、この変異マウスが準致死の性質を示す可能性が考えられる。最近ヒトで、これまでの -1,4-GalT活性によるものと考えられた。これにより、この変異マウスが準致死の性質を示す可能性が考えられる。最近ヒトで、これまでの -1,4-GalTと異なる -1,4-GalTと異なる -1,4-GalT II, -1,4-GalT II, -1,4-GalT III, -1,4-GalT III, -1,4-GalT IV, -1,4-GalT IV, -1,4-GalT V, -1,4-GalT V, -1,4-GalT VIの遺伝子がクローニングされ、これらの酵素は糖鎖に新たな機能を賦与していると考えられる。従って、 -1,4-GalT VIの遺伝子がクローニングされ、これらの酵素は糖鎖に新たな機能を賦与していると考えられる。従って、 -1,4-GalTファミリーのそれぞれの酵素の基質特異性や分布や機能を解析しながら、糖タンパク質糖鎖に見出される -1,4-GalTファミリーのそれぞれの酵素の基質特異性や分布や機能を解析しながら、糖タンパク質糖鎖に見出される -1,4-結合したGalのもつ機能を解折してゆく必要がある。 -1,4-結合したGalのもつ機能を解折してゆく必要がある。 |
| 審査要旨 | | 哺乳動物の発生分化には、細胞表面の糖鎖が重要な役割を果たしている。本研究では細胞表面糖鎖の主たるキャリアーである糖タンパク質について、特に -1,4-結合したガラクトース(Gal)に焦点をあて研究をしている。この糖は -1,4-結合したガラクトース(Gal)に焦点をあて研究をしている。この糖は -1,4-ガラクトース転移酵素( -1,4-ガラクトース転移酵素( -1,4-GalT)により作られ、これにシアル酸をはじめとする糖が付加され、細胞接着に関与する糖鎖抗原などが発現する。そこで -1,4-GalT)により作られ、これにシアル酸をはじめとする糖が付加され、細胞接着に関与する糖鎖抗原などが発現する。そこで -1,4-GalT遺伝子を破壊したマウスを作製し、その個体を解析することにより、下記の結果を得ている。 -1,4-GalT遺伝子を破壊したマウスを作製し、その個体を解析することにより、下記の結果を得ている。 1. -1,4-GalT欠損マウスの表現型の解析: -1,4-GalT欠損マウスの表現型の解析:  -1,4-GalT欠損マウスは、2箇所の翻訳開始部位とゴルジ体局在化シグナルを含むexon1の大半を、PGKneobpAカセットに置換した遺伝子を導入して作製された。このマウスはメンデルの法則に従い生まれてきたが、離乳期までに約半数が、その後も多くが死亡する準致死の性質を持つことが判明した。しかし、このマウスの直接の死因は未だ不明である。変異マウスには成長遅延がみられ、生後一過性の過形成変化が皮膚と小腸上皮で認められた。マウスの受精や胚発生の過程で、細胞表面の -1,4-GalT欠損マウスは、2箇所の翻訳開始部位とゴルジ体局在化シグナルを含むexon1の大半を、PGKneobpAカセットに置換した遺伝子を導入して作製された。このマウスはメンデルの法則に従い生まれてきたが、離乳期までに約半数が、その後も多くが死亡する準致死の性質を持つことが判明した。しかし、このマウスの直接の死因は未だ不明である。変異マウスには成長遅延がみられ、生後一過性の過形成変化が皮膚と小腸上皮で認められた。マウスの受精や胚発生の過程で、細胞表面の -1,4-GalTや -1,4-GalTや -1,4-結合したGalを含むオリゴ糖が重要であると考えられてきたが、 -1,4-結合したGalを含むオリゴ糖が重要であると考えられてきたが、 -1,4-GalT欠損マウス同士の交配でも妊娠し、子孫が生まれてくることから、生体には他にも -1,4-GalT欠損マウス同士の交配でも妊娠し、子孫が生まれてくることから、生体には他にも -1,4-GalTが存在し、これが機能している可能性が考えられた。 -1,4-GalTが存在し、これが機能している可能性が考えられた。 2. -1,4-GalT欠損マウスの生化学的解析: -1,4-GalT欠損マウスの生化学的解析: 肝臓の免疫組織染色やノーザンブロット解析の結果から、このマウスには -1,4-GalTは発現していないことが判明した。しかし、肝臓や脾臓などの各組織のホモジェネートを酵素源とし -1,4-GalTは発現していないことが判明した。しかし、肝臓や脾臓などの各組織のホモジェネートを酵素源とし -1,4-GalT活性を測定すると、対照マウスに比較して変異マウスでも約10%の活性が存在した。対照マウスの肝臓のミクロソーム画分を可溶化し、 -1,4-GalT活性を測定すると、対照マウスに比較して変異マウスでも約10%の活性が存在した。対照マウスの肝臓のミクロソーム画分を可溶化し、 -1,4-GalTをゲル濾過力ラムで分画すると2つの酵素活性のピークが得られたが、変異マウスではその1つに対応するピークが欠失し、このことから生体には少なくとも分子量の異なる2つの -1,4-GalTをゲル濾過力ラムで分画すると2つの酵素活性のピークが得られたが、変異マウスではその1つに対応するピークが欠失し、このことから生体には少なくとも分子量の異なる2つの -1,4-GalTが存在することが判明した。 -1,4-GalTが存在することが判明した。 3. -1,4-GalT欠損マウスの糖鎖構造の解析: -1,4-GalT欠損マウスの糖鎖構造の解析:  -1,4-結合したGalを認識するレクチン(RCA-l)を用いて、この -1,4-結合したGalを認識するレクチン(RCA-l)を用いて、この -1,4-GalT欠損マウスの血清や肝臓の糖タンパク質に少量ではあるがRCA-lと結合する糖タンパク質が存在することを証明した。また酵素消化法を併用してこの変異マウスのAsn型糖鎖上にもGal -1,4-GalT欠損マウスの血清や肝臓の糖タンパク質に少量ではあるがRCA-lと結合する糖タンパク質が存在することを証明した。また酵素消化法を併用してこの変異マウスのAsn型糖鎖上にもGal 1→4GlcNAc→構造が存在すること、しかし多くの糖鎖はGlcNAcで生合成が停止していることを示した。実際、血清糖タンパク質からヒドラジン分解によりAsn型糖鎖を遊離させその構造を解析したところ、正常マウスの糖鎖の約10%に 1→4GlcNAc→構造が存在すること、しかし多くの糖鎖はGlcNAcで生合成が停止していることを示した。実際、血清糖タンパク質からヒドラジン分解によりAsn型糖鎖を遊離させその構造を解析したところ、正常マウスの糖鎖の約10%に -1,4-結合したGalが存在することを証明した。 -1,4-結合したGalが存在することを証明した。 4. -1,4-GalT欠損マウス脳の糖鎖抗原の解析: -1,4-GalT欠損マウス脳の糖鎖抗原の解析:  -1,4-GalT欠損マウスには行動異常や神経網構築に異常が認められなかったので、神経組織構築に重要な役割を持ち、かつGal -1,4-GalT欠損マウスには行動異常や神経網構築に異常が認められなかったので、神経組織構築に重要な役割を持ち、かつGal 1→4GlcNAc→構造上に発現するポリシアル酸とHNK-1糖鎖抗原を解析した。その結果、これらの糖鎖抗原の発現量に、対照マウスと有意な差がないことを証明した。また脳の糖タンパク質を用いたレクチンブロットの結果から、Gal 1→4GlcNAc→構造上に発現するポリシアル酸とHNK-1糖鎖抗原を解析した。その結果、これらの糖鎖抗原の発現量に、対照マウスと有意な差がないことを証明した。また脳の糖タンパク質を用いたレクチンブロットの結果から、Gal 1→4GlcNAc→構造の発現量に変化は見られなかった。また脳での 1→4GlcNAc→構造の発現量に変化は見られなかった。また脳での -1,4-GalT活性は対照マウスの約70%存在し、別の -1,4-GalT活性は対照マウスの約70%存在し、別の -1,4-GalTが存在することを示した。 -1,4-GalTが存在することを示した。 5. -1,4-GalT欠損マウス血清IgGの糖鎖構造の解析: -1,4-GalT欠損マウス血清IgGの糖鎖構造の解析: ヒト慢性関節リウマチでは血清IgGの糖鎖でGalの含量が減少することが知られている。この -1,4-GalT欠損マウスで関節炎が見られないことから、変異マウス血清からIgGを精製し糖鎖構造を解析した。その結果、対照マウスの血清IgGの糖鎖では約70%が -1,4-GalT欠損マウスで関節炎が見られないことから、変異マウス血清からIgGを精製し糖鎖構造を解析した。その結果、対照マウスの血清IgGの糖鎖では約70%が -1,4-結合したGalを持つのに対して、この -1,4-結合したGalを持つのに対して、この -1,4-GalT欠損マウスの血清IgGでは約8%であることを示した。ヒト慢性関節リウマチの病因として血清IgGのGal含量の低下が重要な役割を果たしているのか解析の必要がある。 -1,4-GalT欠損マウスの血清IgGでは約8%であることを示した。ヒト慢性関節リウマチの病因として血清IgGのGal含量の低下が重要な役割を果たしているのか解析の必要がある。 以上、本論文は -1,4-GalT欠損マウスにGal -1,4-GalT欠損マウスにGal 1→4GlcNAc→構造が存在し、これは未知の 1→4GlcNAc→構造が存在し、これは未知の -1,4-GalTによる事を示した。また臓器により、未知の -1,4-GalTによる事を示した。また臓器により、未知の -1,4-GalTの発現レベルが異なることも明らかにした。今日までの糖鎖の生合成に関して、「1グルコシド結合1酵素」と信じられ、 -1,4-GalTの発現レベルが異なることも明らかにした。今日までの糖鎖の生合成に関して、「1グルコシド結合1酵素」と信じられ、 -1,4-GalTは1つしかないと考えてきた歴史を本研究は塗り替えるものである。本研究の一部が公表されたことを契機に世界中で -1,4-GalTは1つしかないと考えてきた歴史を本研究は塗り替えるものである。本研究の一部が公表されたことを契機に世界中で -1,4-GalTのクローニングが盛んに行われ、現在新たに5つの -1,4-GalTのクローニングが盛んに行われ、現在新たに5つの -1,4-GalTがヒトで報告されるまでに至った、本論文は医学のなかの糖鎖生物学に多大な貢献を成すと考えられ、学位の授与に値するものと考えられる。 -1,4-GalTがヒトで報告されるまでに至った、本論文は医学のなかの糖鎖生物学に多大な貢献を成すと考えられ、学位の授与に値するものと考えられる。 |