本研究は、癌抑制遺伝子p53により誘導される新規遺伝子を単離することにより、p53の細胞内での新たな生物学的機能を解明するため、p53の塩基配列特異的なDNAへの結合部位を利用したヒトゲノム解析を用いて新規遺伝子の単離および構造的特徴、生物学的機能を検討したものであり、下記の結果を得ている。 1.癌抑制遺伝子p53の標的遺伝子として新規遺伝子CSR(Cellular Stress Response)が単離された。CSR遺伝子は4.0kbと1.9kbの2つの選択的スプライシングによる転写産物が存在しそれぞれCSR1(606アミノ酸),CSR2(466アミノ酸)と命名した.CSRの第2イントロンにp53の機能的結合部位と思われる配列が存在し、大腸癌、胃癌、前立腺癌、乳癌等で高頻度にLOHが認められるヒト染色体8p12-p21にマップされ、様々な疾患に関与する可能性が示唆された。 2.CSR1は構造的にマクロファージスカベンジャー受容体II型と類似しており,CSR2はsensor蛋白と類似していると予想された。CSR1は膜貫通ドメイン、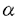 -ヘリックスcoiled-coilドメインとコラゲン様ドメインを持ち、CSR2蛋白はそのうち,C末端のコラゲン様ドメインを持たなかった。CSR蛋白の膜貫通ドメインはロイシン・ジッパー様ドメインと重複し、CSR蛋白がポリマーとして機能している可能性が示唆された。リン酸化部位、糖化部位が多数存在することが推定され、CSRが転写後に修飾を受けることが示唆された。 -ヘリックスcoiled-coilドメインとコラゲン様ドメインを持ち、CSR2蛋白はそのうち,C末端のコラゲン様ドメインを持たなかった。CSR蛋白の膜貫通ドメインはロイシン・ジッパー様ドメインと重複し、CSR蛋白がポリマーとして機能している可能性が示唆された。リン酸化部位、糖化部位が多数存在することが推定され、CSRが転写後に修飾を受けることが示唆された。 3.野生型もしくは変異型(Arg273His)p53を細胞株H1299(p53-/-)にそれぞれ導入すると,CSR発現は野生型p53の導入により誘導されるが、変異型の導入では誘導されなかった。EMSAの結果、CSR遺伝子のp53結合配列に野生型のp53が結合し、CSRの転写誘導を調節する可能性が示唆された.しかしながら,野生型p53もしくは変異型p53を持つ種々の細胞株でのCSRの発現は,p53の型と相関しなかった.以上よりCSRの発現が野生型のp53により調節されるが,他の未知の因子も関与すると示唆された。 4.ヒト正常線維芽細胞を用いて、細胞傷害を与えたときのCSR発現変化をノザン解析及びRT-PCRにて観察した結果、15J/m2の紫外線の照射、10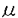 M過酸化水素投与、他の酸化ストレス誘導剤DEM、PMA(TPA),Sodium azide、arsenite、GSNOおよびSNP処理により、CSR発現が著明に誘導されることが確認された。CSR発現にはDNA傷害は大きく影響を与えず、抗酸化活性を持つN-acetylcysteine(NAC)で細胞を処理したところ,CSR発現の増加は認められなかった。このことは細胞に対する酸化ストレスがCSR発現誘導の主要因子であることを支持するものであると考えられた。CSR蛋白は細胞質中の小胞体/ゴルジ体に発現することが、HAタグを付加したCSR遺伝子をHeLa細胞に過剰発現させ、蛍光免疫染色を施行することで確認された。酸化ストレス負荷後、CSR蛋白の局在は細胞質全体に拡散することが確認され,酸化ストレスに対応していると考えられた。 M過酸化水素投与、他の酸化ストレス誘導剤DEM、PMA(TPA),Sodium azide、arsenite、GSNOおよびSNP処理により、CSR発現が著明に誘導されることが確認された。CSR発現にはDNA傷害は大きく影響を与えず、抗酸化活性を持つN-acetylcysteine(NAC)で細胞を処理したところ,CSR発現の増加は認められなかった。このことは細胞に対する酸化ストレスがCSR発現誘導の主要因子であることを支持するものであると考えられた。CSR蛋白は細胞質中の小胞体/ゴルジ体に発現することが、HAタグを付加したCSR遺伝子をHeLa細胞に過剰発現させ、蛍光免疫染色を施行することで確認された。酸化ストレス負荷後、CSR蛋白の局在は細胞質全体に拡散することが確認され,酸化ストレスに対応していると考えられた。 5.細胞内のCSRの機能を調べるためにCSR1/CSR2、CSR1のみ、CSR2のみ、vectorのみを過剰発現させた細胞を用いて酸化ストレス負荷後の、生存テスト(MTT法)、FCMおよび検鏡下での形態変化の観察をおこなった。CSR1とCSR2を共に発現させた細胞は、CSR1、CSR2それぞれのみ、もしくはvectorのみを発現させた細胞と比較し、酸化ストレスに対する強い抵抗性を有することが確認された。細胞内の酸化状態の指示薬DCFH-DAをもちいてFCMを行ったところ、CSR1とCSR2を共に発現させた細胞は他の細胞と比較し、細胞内の活性酸素の増加が抑制されていた。また形態学的にもCSR1とCSR2を共に発現させた細胞はvectorのみを発現させた細胞と比較して正常の形態を早期に回復した。以上よりCSR1およびCSR2は細胞内の反応性酸化中間産物を除去することで細胞を酸化ストレスより防御すると考えられた。 以上、本論文はp53結合部位をもち、酸化ストレスにより強く誘導される新規遺伝子CSRの単離および構造的特徴、生物学的機能を解析したものである。CSR遺伝子の発現は酸化ストレスにより産生される活性酸素を除去することにより細胞を防御する役割を担っている。酸化ストレスは癌および他の疾患の発症原因となるため、CSRの遺伝子の機能欠損は様々な疾患に関与する可能性が非常に高い。CSR遺伝子はp53と結合することが確認されたが、p53のみによる調節は弱く、p53以外の酸化ストレス関連転写因子よってその発現を増加させる可能性が示唆された。以上よりCSR遺伝子は酸化ストレス下で細胞の増殖を制御するレドックス関連シグナル伝達機構のクロスポイントに位置すると思われた。今後、CSRとp53およびCSRと酸化ストレス関連転写因子により調節される細胞内の活性酸素の増減を検討することにより、酸化ストレスによる疾患発症過程の理解への道が開かれることが期待されると考えられ、本論文は学位の授与に値するものと考えられる。 |