学位論文要旨
| No | 214039 | |
| 著者(漢字) | 齊藤,恭子 | |
| 著者(英字) | ||
| 著者(カナ) | サイトウ,キョウコ | |
| 標題(和) | 哺乳動物細胞のホスファチジルセリン合成酵素IとIIに関する遺伝生化学的研究 | |
| 標題(洋) | ||
| 報告番号 | 214039 | |
| 報告番号 | 乙14039 | |
| 学位授与日 | 1998.11.11 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第14039号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | リン脂質は哺乳動物細胞の形質膜やオルガネラ膜の主要構成成分であり、各生体膜で固有の組成を形成している。従って、生体膜の構築とその機能を支える仕組みを理解する上で、膜リン脂質の代謝と機能を明らかにすることは重要であると思われる。 ホスファチジルセリン(PS)は、哺乳動物細胞の主要膜リン脂質の一つであるが、その代謝機構と機能については不明な点が多く残されている。PS合成能が損傷したチャイニーズハムスター卵巣由来CHO-K1細胞変異株(PSA-3)の解析から、哺乳動物細胞のPSは、既存のリン脂質の極性基部分とセリンとの交換反応(セリン交換反応)により合成されることが明らかとなった[1]。PSA-3株は増殖に外因性PSを必要とし、PS非存在下ではPSとPSから合成されるホスファチジルエタノールアミン(PE)の含量が減少する。同変異株はセリン交換活性が、親株CHO-K1の半分に低下しており、親株に認められるホスファチジルコリン(PC)をPSに変換する反応が欠失している。一方PSA-3株では、PEをPSに変換する反応は親株と同様に認められ、同変異株をPE添加培地で培養すると、PS合成能と増殖能が回復する[2]。これらの結果から、CHO細胞にはPCをPSに変換するセリン交換酵素(PS合成酵素I、PSSI)とPEをPSに変換するセリン交換酵素(PSSII)が存在すること、また、PSA-3株に欠損するPSSIは、PSとPEの生合成に重要であることが示唆された。 これまでにPSA-3株を利用して、同変異株のPSSI欠損を相補するCHO細胞の遺伝子(pssA)が分離されている[3]。しかし、pssA遺伝子産物がPSSIそのものであるのか、PSSI活性に必須の制御蛋白質なのかは不明のまま残されていた。一方、PSSIIはその変異株や遺伝子が分離されておらず、その実体とPS代謝における機能は全くわかっていなかった。 私は、哺乳動物細胞におけるPS代謝機構をさらに明確にすることを目的として、1)pssA遺伝子産物に対する抗体を作成して、同遺伝子産物がPSSIである可能性を検討した。さらに、2)PSSIIに損傷を有するCHO細胞変異株を分離し、PSSIIのPS代謝における役割を解析した。 pssA遺伝子産物の2種の部分アミノ酸配列に対する抗体を作成し、イムノブロット解析、あるいは免疫沈降で、両抗体がCHO-K1株の42k膜蛋白質に結合することを見出した。42k蛋白質はPSA-3株には全く検出されなかったが、同変異株にpssAcDNAを導入したCDT-1株では過剰発現していた(図1)。以上の結果から、42k膜蛋白質がpssA遺伝子産物であると結論した。  CDT-1株の膜画分では、42k蛋白質の増加に伴い、PSSI活性がCHO-K1株膜画分の約20倍に増加していた。そこで、CDT-1株膜画分を可溶化し、pssAペプチド対する抗体で42k蛋白質を免疫沈降させたところ、上清のPSSI交換活性が減少した(図2)。また、PSSI活性と42k蛋白質のCHO-K1細胞内の分布はよく一致し、いずれもミクロソーム画分とミトコンドリア周辺の小胞体膜画分であるmitochondria-associated membraneに濃縮された。以上の結果から、pssA遺伝子産物はPSSIであることが証明された。 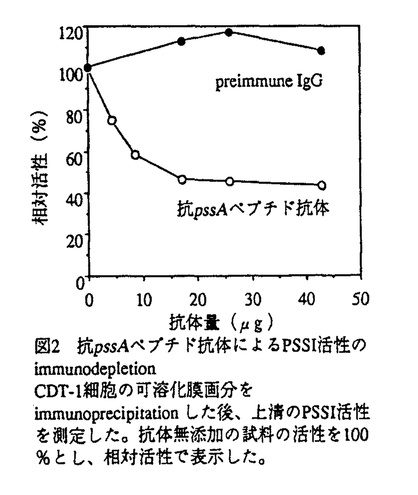 PSSI活性を欠損するPSA-3株を変異剤で処理後、コロニーレプリカ法によりセリン交換活性が低下した変異株を検索し、同活性が親株PSA-3の約10%に低下したPSB-2株を分離した。最近、PSSIと相同性を示す蛋白質をコードするCHO細胞のcDNAの検索から、PSSIとは異なるセリン交換酵素(PSSIIと命名)の遺伝子(pssB)が分離されたが[4]、PSB-2株ではpssB遺伝子のmRNA発現量が、親株PSA-3と野生株CHO-K1の約20%に低下していた(図3)。従って、PSB-2株はpssB遺伝子のコードするPSSIIに損傷を有することが明らかとなった。  PSA-3株は、リン脂質無添加の培地では増殖せず、PS又はPEを添加した培地で増殖することが知られている。PSB-2株は親株PSA-3と同様に、リン脂質非存在下では増殖せず、PS存在下で増殖した。しかし、PSB-2株はPSA-3株と異なり、PE存在下では増殖しなかった。両変異株は、リン脂質非存在下でPSとPEの含量が低下し、PS存在下で正常なリン脂質組成を示した。ところがPE存在下では、PSA-3株が正常なリン脂質組成を示したのに対し、PSB-2株はPS含量の低下を示した。従ってPSB-2株では、PSA-3株に認められた外因性PEに依存した増殖能とPS合成能の回復が認められないことが明らかとなった。さらに、両変異株を[32P]PEで代謝標識し、PEをPSへ変換する活性を調べた結果、PSB-2株は、PSA-3株に比べて同活性が著しく低下していることがわかった。 PSB-2株にPSSIIのcDNA(pssB)を導入し、親株PSA-3株と同程度までPSSII活性が回復した形質転換株、PSB-2/pssBを分離した。PSB-2/pssB株は、PSB-2株では認められなかったPE存在下の増殖能、PS合成能が回復したことから、PSSIIはPSA-3株に認められたPE依存の増殖とPSの生合成に必須であることが示された。 さらに、PSSIIにのみ損傷を有する細胞を得るために、PSB-2株にPSSIのcDNA(pssA)を導入し、PSSI活性がCHO-K1株の約半分まで回復した形質転換株、PSB-2/pssAを分離した。PSB-2/pssA株はPSやPEの添加の有無に関わらず、リン脂質無添加培地でも、正常な増殖能とPS合成能を獲得していた。この結果から、PSSIが存在する場合には、PSSIIは細胞の増殖とPS生合成に必須ではない可能性と、PSSIIの損傷がleakyであるため、表現型として表れなかったという可能性が考えられた。従って、CHO細胞の増殖とPS生合成におけるPSSIIの重要性については明確な答えが得られず、PSSIIの完全欠損変異株の分離が必要であると考えられた。 PSSII導入株PSB-2/pssBではPSB-2株と異なり、PSA-3株、CHO-K1株と同程度までPEをPSに変換する活性が回復していた。しかし、PSSI導入株PSB-2/pssAの同活性は、PSB-2株と同様に低下したままであった。従って、PSSIIはPEをPSに変換する反応を触媒すること、PSSIはこの反応を触媒しないことが明らかとなった。また、PCをPSへ変換する活性も調べたところ、PSB-2株はPSA-3株と同様に同活性を欠損していたが、PSB-2/pssB株も同様であった。しかし、PSB-2/pssA株はPCをPSへ変換する活性が正常レベルに回復していた。従って、PSSIはPCをPSに変換する反応を触媒し、PSSIIは同反応を触媒しないことが確かめられた。  本研究は、pssA遺伝子がコードする分子量42-kの膜蛋白質がPSSIであることを示した。さらに、pssB遺伝子がコードするPSSIIは、PEをPSに変換する反応を触媒し、PSSI欠損株PSA-3のPE存在下での増殖とPS生合成に必須であることを明らかにした。従って、CHO細胞では、PSSIが触媒するPCをPSに変換する経路と、PSSIIが触媒するPEをPSに変換する経路によって、PSが生合成されると結論された。本研究で得られたPSSIとPSSIIの両方に損傷を有するPSB-2株は、PE存在下に培養するとPSだけが減少することから、PSの機能を研究する上で有用な素材となることが期待される。 | |
| 審査要旨 | この論文は、生体膜のリン脂質の一つであるのホスファチジルセリン(PS)の合成系を哺乳動物細胞を用いて遺伝生化学的に解析したものである。これまでに、PS合成能に欠損のあるチャイニーズハムスター由来のCHO-K1細胞の変異株(PSA-3)の解析から、PSは既存のリン脂質の極性基とセリンとの交換反応により合成されることが示されていた。そしてこの交換反応を触媒する酵素は、PCをPSと交換する酵素(PSSI)と、PEをPSと交換する酵素(PSSII)の二種類が存在することが示唆されていた。しかし、その酵素の実体については知見が乏しかった。 この論文はこの二つの酵素について、分子生物学的あるいは遺伝性化学的な検討を加えたもので、2章より成っている。第1章では、PSA-3株が欠失していると考えられるPSSI活性を相補する遺伝子(pssA)を単離し、この遺伝子がPSSIそのものをコードしていると結論した。その主たる理由は、pssA産物が42kDaの蛋白であり、この蛋白をPSA-3株中で過剰発現させるとPSSI活性が20倍以上に上昇すること、42kDaの蛋白の細胞内分布はPSSI活性のそれとよく一致すること等である。この結果、PCとPSを交換する酵素(PSSI)の実体が哺乳動物ではじめて明確になった。 第2章では、PSSIIの変異株を分離し、その実体を明らかにした。すなわち、PSA-3株を更に変異剤で処理する事により、セリン交換活性が低下した株をスクリーニングし、同活性が親株の10%以下に低下したPSB-2株を得た。次に、このセリン交換活性を相補する遺伝子pssBを同定した。PSB-2株と親株のPSA-3株を用いて、PEをPSに変換する活性を測定したところ、PSB-2株では明らかにこの活性が低下しており、pssBがPSSIIをコードする遺伝子であることが分かった。またcDNAクローニングによりPSSIIは474アミノ酸残基よりなることも判明した。これら一連の研究から、PSSIIはPSA-3株のPE-PSの変換に必須な酵素であることが示された。PSSI欠損株PSA-3はPE存在下に増殖できるが、PSB-2はPEが存在しても増殖できない。しかもこの条件下ではPSの含量は顕著に低下することも分かった。このような表現形から推して、PSB-2株は将来PSの機能を解析する上で重要な情報を提供するものと思われる。 以上この論文は、CHO細胞のPS合成系を解析し、PCとPSを変換する酵素PSSIと、PEとPSを変換する酵素PSSIIの実体を遺伝子レベルで明らかにし、PSの機能の解析に新しい展開をもたらすと考えられる変異株について記載している。これらの成果は細胞生物学の進展に寄与するものであり、博士(薬学)の学位に値するものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/51097 |