ウェルシュ菌が産生する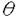 毒素は、動物細胞膜のコレステロールを認識して膜に結合し、膜内に侵入し会合した毒素分子が膜を貫通するポアを形成して膜破壊を引き起こす。近年、 毒素は、動物細胞膜のコレステロールを認識して膜に結合し、膜内に侵入し会合した毒素分子が膜を貫通するポアを形成して膜破壊を引き起こす。近年、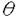 毒素は動物細胞に温和な条件で穴をあける道具として、また細胞膜コレステロールを特異的に染色するプローブとして注目されている。本論文は、細胞膜破壊過程における 毒素は動物細胞に温和な条件で穴をあける道具として、また細胞膜コレステロールを特異的に染色するプローブとして注目されている。本論文は、細胞膜破壊過程における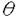 毒素の構造と活性発現との関連について述べたものであり、序論と3章、結語より構成されている。 毒素の構造と活性発現との関連について述べたものであり、序論と3章、結語より構成されている。 序論において研究の背景を述べた後、第1章では、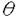 毒素のリポソーム膜との相互作用における構造変化を円二色性(CD)および蛍光スペクトルによって検討した結果を述べている。 毒素のリポソーム膜との相互作用における構造変化を円二色性(CD)および蛍光スペクトルによって検討した結果を述べている。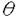 毒素は216nm付近に負のCD帯を待ち、 毒素は216nm付近に負のCD帯を待ち、 構造に富んでいる。コレステロールを含むリポソームとの相互作用により、 構造に富んでいる。コレステロールを含むリポソームとの相互作用により、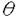 毒素の二次構造には大きな変化は認められなかったが、 毒素の二次構造には大きな変化は認められなかったが、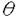 毒素の芳香族側鎖、特にトリプトファン残基近傍に大きな構造変化が生じていることが明らかになった。これらの変化はコレステロールを含まないリポソームでは認められなかった。ブロム原子を導入したリポソームに 毒素の芳香族側鎖、特にトリプトファン残基近傍に大きな構造変化が生じていることが明らかになった。これらの変化はコレステロールを含まないリポソームでは認められなかった。ブロム原子を導入したリポソームに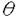 毒素を作用させるとトリプトファン蛍光の消光が認められ、毒素の膜との相互作用領域にトリプトファン残基が存在していることが示唆された。また、膜結合能を有するが、会合体形成能を欠く修飾毒素MC 毒素を作用させるとトリプトファン蛍光の消光が認められ、毒素の膜との相互作用領域にトリプトファン残基が存在していることが示唆された。また、膜結合能を有するが、会合体形成能を欠く修飾毒素MC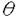 の膜との相互作用を の膜との相互作用を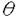 毒素の場合と比較した結果、会合体形成に伴う292nmのCDピークの消失と300nmのCDピークの出現が認められ、毒素分子の会合体形成時にトリプトファン残基近傍に構造変化が起こることが示唆された。 毒素の場合と比較した結果、会合体形成に伴う292nmのCDピークの消失と300nmのCDピークの出現が認められ、毒素分子の会合体形成時にトリプトファン残基近傍に構造変化が起こることが示唆された。 第2章では、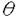 毒素の膜破壊におけるトリプトファン残基の役割について述べている。 毒素の膜破壊におけるトリプトファン残基の役割について述べている。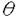 毒素は、他のコレステロール結合性細胞膜溶解毒素群と一次構造上高い相同性があり、特にC末端付近の11残基のアミノ酸配列(ECTGLAWEWWR)はこれらの毒素において完全に保存されている。 毒素は、他のコレステロール結合性細胞膜溶解毒素群と一次構造上高い相同性があり、特にC末端付近の11残基のアミノ酸配列(ECTGLAWEWWR)はこれらの毒素において完全に保存されている。 毒素には7個のトリプトファン残基があり、そのうち3個(Trp436,Trp438,Trp439)が保存配列内にある。部位特異的変異によりこれらトリプトファン残基をフェニルアラニンに置換した変異毒素を作製し、膜破壊過程におけるトリプトファン残基の役割を検討した。変異毒素のCDスペクトルの解析により、Trp436は二次構造の保持に、Trp436,Trp438,Trp439は側鎖領域の環境を保つ上でそれぞれ重要であることが示唆された。変異毒素(W436F,W438F,W439F,W438/439F)はいずれも溶血活性が低下し、赤血球膜およびリポソーム膜への結合能も低下した。プロム化リポソームを用いた消光実験により、436番と438番のトリプトファン残基が毒素の膜への侵入に関わっていることが示唆された。いずれの変異毒素も会合体を形成できるので、これらの変異毒素の溶血活性の差は主として膜への結合や侵入の段階での違いを反映すると考えられる。近紫外CDスペクトルの解析により、会合体形成における構造変化はTrp438とTrp439の近傍に起こっていることが示唆された。 毒素には7個のトリプトファン残基があり、そのうち3個(Trp436,Trp438,Trp439)が保存配列内にある。部位特異的変異によりこれらトリプトファン残基をフェニルアラニンに置換した変異毒素を作製し、膜破壊過程におけるトリプトファン残基の役割を検討した。変異毒素のCDスペクトルの解析により、Trp436は二次構造の保持に、Trp436,Trp438,Trp439は側鎖領域の環境を保つ上でそれぞれ重要であることが示唆された。変異毒素(W436F,W438F,W439F,W438/439F)はいずれも溶血活性が低下し、赤血球膜およびリポソーム膜への結合能も低下した。プロム化リポソームを用いた消光実験により、436番と438番のトリプトファン残基が毒素の膜への侵入に関わっていることが示唆された。いずれの変異毒素も会合体を形成できるので、これらの変異毒素の溶血活性の差は主として膜への結合や侵入の段階での違いを反映すると考えられる。近紫外CDスペクトルの解析により、会合体形成における構造変化はTrp438とTrp439の近傍に起こっていることが示唆された。 第3章では、 毒素の膜破壊作用に及ぼすpHの影響について検討した結果を述べている。溶血活性はpH5〜7で最大となり、pH8以上では著しく低下した。リポソーム膜との相互作用による毒素分子の構造変化もpH5〜7で最大となった。W438F,W439F,W438/439Fでは至適pHが酸性側に移行し、これらトリプトファン残基の置換が活性に関与する解離基に影響を及ぼしていることが示唆された。さらに、ジエチルピロカーボネイトにより毒素のヒスチジン残基を修飾し、活性に及ぼす影響を調べた結果、野生型のみならずトリプトファン置換毒素も失活し、膜破壊におけるヒスチジン残基の関与が明らかになった。 毒素の膜破壊作用に及ぼすpHの影響について検討した結果を述べている。溶血活性はpH5〜7で最大となり、pH8以上では著しく低下した。リポソーム膜との相互作用による毒素分子の構造変化もpH5〜7で最大となった。W438F,W439F,W438/439Fでは至適pHが酸性側に移行し、これらトリプトファン残基の置換が活性に関与する解離基に影響を及ぼしていることが示唆された。さらに、ジエチルピロカーボネイトにより毒素のヒスチジン残基を修飾し、活性に及ぼす影響を調べた結果、野生型のみならずトリプトファン置換毒素も失活し、膜破壊におけるヒスチジン残基の関与が明らかになった。 結語では、本研究の成果とこれまでの知見を基に、総合的な討論を行っている。 以上、本論文は、ウェルシュ菌 毒素の膜破壊機構について解析を行い、 毒素の膜破壊機構について解析を行い、 毒素は膜コレステロールとの相互作用により、二次構造は保ちつつ、アミノ酸側鎖の微細な構造変化を経て膜内に侵入し、膜破壊を引き起こすことを明らかにしたものであり、学術上、応用上貢献するところが少なくない。よって審査委員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 毒素は膜コレステロールとの相互作用により、二次構造は保ちつつ、アミノ酸側鎖の微細な構造変化を経て膜内に侵入し、膜破壊を引き起こすことを明らかにしたものであり、学術上、応用上貢献するところが少なくない。よって審査委員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 |