本研究はアンドロゲン除去後にアポトーシスが誘導されることが知られている前立腺癌においてFas-Fas ligand system(Fas system)の刺激でアポトーシスが誘導されるかを明らかにするため、PC-3とLNCaPの2つのヒト前立腺癌細胞系を用いて、Fas遺伝子導入後にFas刺激を行いアポトーシスの誘導を試みたものであり、下記の結果を得ている。 1.無処置のPC-3とLNCaPおよび、vectorだけを導入したコントロールのPC-3とLNCaPは、免疫細胞化学でもフローサイトメトリーでもFasを発現していなかった。Fasを導入したPC-3 clone(PCFas1,PCFas2,PCFas3)とFasを導入したLNCaP clone (LNFas1,LNFas2)は、免疫細胞化学やフローサイトメトリー上Fasを発現していた。Fas遺伝子導入によりPC-3とLNCaPにおいて、もともとは存在しないFasが発現したことが示された。 2.MTT assayでは、PCFas1の増殖はコントロールに比べると24、48、72、96時間後には有意に抑制された。一方、LNFas2の増殖はコントロールに比べて72、96時間後に有意に強まった。Fas導入はPC-3の増殖を抑制するが、LNCaPでは逆に増強することが示された。Fasを導入しても、PCFas1はアンドロゲン不応性のままでありLNFas2はアンドロゲン反応性のままであった。さらにLNFas2のアンドロゲン反応性はコントロールに比べて0.01、0.1、1nMのすべての濃度で有意に増強された。Fas導入によりPC-3のアンドロゲン不応性に変化はなかったが、LNCaPのアンドロゲン反応性は増強された。 3.コントロールのPC-3はCH-11によるFas刺激ではアポトーシスが誘導されなかったが、Fasを導入したPC-3clone(PCFas1,PCFas2,PCFas3)では明らかな細胞の縮小、多数の空胞、粗いクロマチンの凝集を24時間後には認め、アポトーシスが誘導された。電顕上でも核の断裂、多数の空胞、アポトーシス体、細胞膜の足突起の消失を認め、アポトーシスが確認された。一方、コントロールのLNCaPやFasを導入したLNCaP clone(LNFas1,LNFas2)では、CH-11投与24時間後でも、アポトーシスが誘導されなかった。PC-3はFas導入後に抗体投与によるFas感受性を獲得したが、LNCaPはFas導入後もFas抵抗性のままであった。 4.MTT assayでは、PCFas1は、コントロールと異なりCH-11投与によるFas刺激で、増殖が0.1、0.5、2.5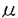 g/mlのすべての濃度で有意に抑制されたが、LNFas2では2.5 g/mlのすべての濃度で有意に抑制されたが、LNFas2では2.5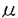 g/mlの濃度の時のみ少し抑制されただけであった。これは上に述べた光顕と電顕の結果に全く一致した。 g/mlの濃度の時のみ少し抑制されただけであった。これは上に述べた光顕と電顕の結果に全く一致した。 5.マウスの皮下に植えられたコントロールPC-3とPCFas1は、抗体投与とは無関係に、PCFas1の増殖はコントロールのPC-3に比べて5、6週後には有意に抑制されていた。in vivoでもin vitroと同様にPC-3の増殖はFas導入により抑制された。CH-11腹腔内注射でのFas刺激によりterminal transferase labelingと電顕でアポトーシスが明らかであった。in vivoでもFas導入後のPC-3ではFas刺激によるアポトーシス誘導が確認された。 以上、本論文は、ヒト前立腺癌細胞系においてFas遺伝子導入後Fas刺激によりアポトーシスが誘導されることを明らかにした。またともにアンドロゲン非依存性であるが、アンドロゲン不応性のPC-3とアンドロゲン反応性のLNCaPではFas導入後のFas感受性が異なることも明らかにした。このように本研究はこれまで余り知られていなかった前立腺癌におけるアンドロゲン除去後のアポトーシスとFas systemの関係の解明に大きな貢献をなすと考えられ、学位の授与に値するものと考えられる。 |