I型アレルギーの治療に対し、減感作療法や経口免疫寛容が有効な可能性が高い。しかしながら、天然物からの粗抽出物を用いた場合、他の成分の影響も無視できなく判断があいまいになることも多い。また、粗抽出物から主要なアレルゲンを精製するとなると膨大な時間と資金を要することになり、減感作療法を多くの人々に試みることが困難であった。そこで組換えDNA技術を用い、組換えタンパクとして大量生産することが検討されるようになった。 Der fIはコナヒョウヒダニ(Dermatophagoides farinae)由来の糖タンパクであり、ダニアレルギー患者の過半数と反応する主要アレルゲンである。このDer fIを用いた減感作療法を容易に施すことが可能となれば多くのダニアレルギー患者にとって朗報となろう。しかしながらダニは小さく生育速度が遅いことから、Der fIを大量に入手することは困難であった。そこで先に述べたように組換え体としての生産が試みられた。Der fI cDNAはすでにクローニングされていたが、E.coliを宿主として生産した組換えDer fIはインクルージョンボディーとなり、可溶化した組換えDer fIにはIgE結合活性が認められなかった。Der fIと高いホモロジーを持つヤケヒョウヒダニ(Dermatophagoides pteronyssinuss)由来のDer pIをSaccharomyces cerevisiaeを宿主として用い組換えタンパクとしての生産を試みたところ菌体内に不溶化状態で生産され、これを可溶化した組換えDer pIのIgE結合活性ははっきりと確認できなかった。モノクローナル抗体を用いて精製を行うことにより、一部の患者のIgEと結合できる組換えDer pIの分離に成功した。しかしながらこの組換えDer pIはプロ配列をもつ前駆体であり、IgE抗体と組換えDer pIとのアフィニティーについては示されていなかった。 Der fI cDNA上にはプレプロ配列が含まれていることから、分泌生産できないか使用する発現系について検討を行った。まずバキュロウイルス発現系を試みた。Der fI cDNAを導入した組換えバキュロウイルスを感染させた昆虫細胞培養上清には、組換えDer fIが分泌生産されていた。この組換えDer fIの分子量は天然型Der fIより大きかった。N末端アミノ酸配列を調べたところ、プロ配列が除去されなかったことが判明した。精製した組換えDer fIのプロ配列は、80アミノ酸を含むものと59アミノ酸を含む2種類の混合物であった。これらを別々に分離精製することはできなかったので、まとめた混合物のIgE結合活性を測定したところ、天然型Der fIの活性の20%程度しか認められなかった。 Der fIはプロテアーゼ活性を持ち、糞中に多く存在し、消化酵素と考えられてきた。消化酵素のあるものは前駆体として生産され、消化器官中で酸性条件下で自己触媒的にプロ配列を除去し成熟体に変換する。そこで、前駆体組換えDer fIにもこのようなプロ配列を除去する作用が生じないか検討を行った。pH、温度、時間を変化させて組換えDer fIの分子量やタンパク量の変化を調べたところ、pHを4.0にし4℃で2日間放置する酸処理により効率的に組換えDer fIの分子量を天然型Der fIと等しくさせることができることが判明した。酸処理した組換えDer fIのN末端アミノ酸配列を調べたところ、プロ配列が除去され、成熟体に変換していることが判明した。しかしながら、そのN末端は均一でなく2種類存在した。1つは天然型Der fIと同一であり、もう1つは2アミノ酸だけプロ配列が残っていた。これらの比率は1:1であった。それぞれを分離精製することができなかったので、まとめてIgE結合活性を測定したところ、タンパク濃度が低いときは天然型Der fIと同等であった。しかしながら、タンパク濃度が高いときは、酸処理した組換えDer fIの方が若干低かった(図1)。 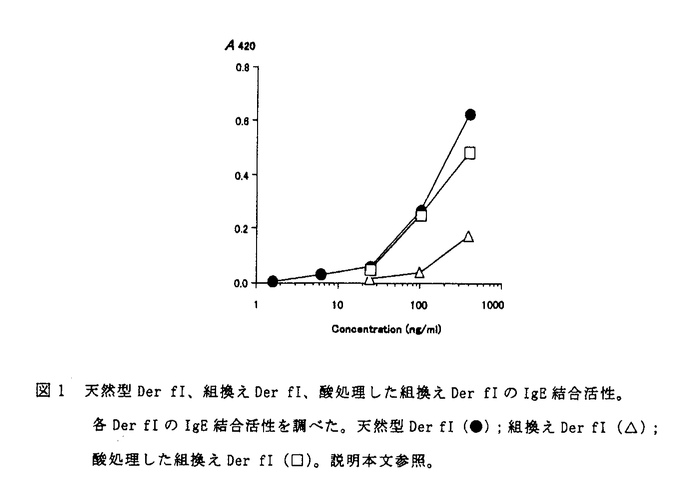 図1 天然型Der fI、組換えDer fI、酸処理した組換えDer fIのIgE結合活性。各Der fIのIgE結合活性を調べた。天然型Der fI(●);組換えDer fI(△);酸処理した組換えDer fI(□)。説明本文参照。 図1 天然型Der fI、組換えDer fI、酸処理した組換えDer fIのIgE結合活性。各Der fIのIgE結合活性を調べた。天然型Der fI(●);組換えDer fI(△);酸処理した組換えDer fI(□)。説明本文参照。 リシルエンドペプチダーゼを用いて組換えDer fIを分解すると、成熟配列中のリジン残基は認識されずプロ配列上のリジン残基のみ認識され8アミノ酸分プロ配列が残存するものが作製できることが判明した。このリシルエンドペプチダーゼ処理された組換えDer fIのIgE結合活性を測定したところ、前駆体のときよりは高いものの、酸処理した組換えDer fIより明らかに低かった。これはわずかにプロ配列が残存していてもIgE結合活性に影響を及ぼすことを示唆している。タンパク濃度が高いときに酸処理した組換えDer fIのIgE結合活性が天然型Der fIより低かったのは、酸処理した組換えDer fIの一部にプロ配列を含むものが残存していたためであるという可能性をなくすために、プロ配列の3’末端コドンをリジンコドンに置換したDer fI E(-1)K DNAを作製し、バキュロウイルス発現系を用い組換えDer fI E(-1)Kを生産し、リシルエンドペプチダーゼ処理により組換えDer fI E(-1)Kのプロ配列を除去した。リシルエンドペプチダーゼ処理の際その他の大部分のタンパクも分解されたため、精製工程が簡略になり生産量に差は認められなかったことにもかかわらず収率が向上した(25mg/L)。リシルエンドペプチダーゼ処理された組換えDer fI E(-1)KのN末端アミノ酸配列を調べたところ、均一で天然型Der fIと同一であった。またIgE結合活性も広いタンパク濃度領域において同等であった。Der fI E(-1)K DNA上にはN型糖鎖が付加される配列が存在しているのでレクチンブロット解析により糖鎖の比較を行ったところ両者に差が認められた。天然型Der fIも組換えDer fI E(-1)Kも共にハイマンノース型の糖鎖が付加されていると推測されたが、天然型Der fIの糖鎖の非還元末端にはグルコサミン残基が付加されているのに対して、組換えDer fI E(-1)Kの糖鎖の非還元末端にはグルコサミン残基が付加されていないこと、組換えDer fI E(-1)Kの糖鎖の中でアスパラギン残基と結合しているグルコサミン残基にフコースが付加されているのに対して、天然型Der fIの糖鎖はそのようになっていないことが示唆された。糖鎖の違いにより新しい抗原性が発生する可能性が考えられた。 減感作療法においては、抗原を直接人体に投与するので、異種タンパクを生産する宿主として、毒性の心配が極力低いものが好ましい。Saccharomyces cerevisiaeは醸造、醗酵に関与しており、その人体への安全性が認められている。そこでSaccharomyces cerevisiaeを用いた組換えDer fI E(-1)Kの分泌生産について検討を行った。実験室酵母を宿主として用いた場合、Der fI E(-1)K DNAを導入した形質転換体の培養上清に組換えDer fI E(-1)Kが分泌生産されていることを確認できなかった。そこで、大量の異種タンパク分泌生産を達成した実績を持つEH13-15株を宿主として用いた。またDer fI E(-1)K DNAのプレプロ配列を、大量の異種タンパク分泌生産を達成した実績を持つRhizopus niveus Aspartic protease-Iのプレプロ配列に置換したDNAを作製し組換えタンパクの分泌生産を試みた。結果的にはプレプロ配列を置換しないDer fI E(-1)K DNAを導入した形質転換体の培養上清にのみ組換えタンパクが検出された。組換えDer fI E(-1)Kに付加される糖鎖は大きく均一でないことから、カラムを用いた精製ができなかった。非変性条件下でも、Endo Hの量を多めにして処理を行ったところ糖鎖が除去された。リシルエンドペプチダーゼ処理等を行い、成熟型組換えDer fI E(-1)Kを精製した。N末端アミノ酸配列は均一で天然型Der fIと同一で、IgE結合活性も天然型Der fIと同等であった。また、糖鎖をEndo Hでグルコサミン残基のみにしているので、糖鎖の違いによる新たな抗原性の発生の可能性は小さいと予想された。この発現系で得られた成熟型組換えDer fI E(-1)Kそのものは非常に有用と考えられたが、生産性が低い(0.6mg/L)ということが問題として残った。 Aspergillus oryzaeは醸造、醗酵に関与しており、宿主として安全であると認められている。また、異種タンパクの生産の報告例も多く、高い生産性を達成した例も多いので、組換えDer fI E(-1)Kの生産について検討を行った。Der fI E(-1)K DNAを導入した形質転換体を作製し振とう培養で発現の誘導を試みたところ、大部分の組換えDer fI E(-1)Kは分解した。条件検討を行い、増殖が緩やかになるように穏やかに振とうしたところ組換えDer fI E(-1)Kの分解が抑制された。精製された成熟型組換えDer fI E(-1)Kの収率は8mg/Lであった。フスマ培養を行うことにより、より高い収率(48mg/kg)で成熟型組換えDer fI E(-1)Kを得ることができた。液体培養とフスマ培養から得られた成熟型組換えDer fI E(-1)KのN末端アミノ酸配列は均一で天然型Der fIと同一で、IgE結合活性だけでなく皮内反応においても天然型Der fIと同等であった。以上のことより、この発現系を用いて生産した成熟型組換えDer fI E(-1)Kは、診断用、減感作療法用として、様々な実験に役立つであろうと期待できる。 |