カンプトテシン(1)(図1)は中国原産の植物Camptotheca acuminataから単離され、構造決定された。カンプトテシンの抗癌剤としての開発は、強い副作用のため中止されたが、カンプトテシンが、トポイソメラーゼIの阻害によりDNAの複製を阻害するという特異な機作を有することが判明したこともあり、その後も多くの類縁体合成研究がなされた。1994年にカンプトテシン誘導体として初めてCPT-11(2)が、続いてtopotecan(3)が上市され、さらに、9-AC(4)、GG-211(6)などが臨床治験中である。筆者は、CPT-11でみられる投与直後の下痢の回避等上市されているカンプトテシン類縁体には改良の余地があると考え、1)次世代のカンプトテシン類縁抗腫瘍薬のための核となる高活性化合物の取得、2)カンプトテシンの修飾の可能性の探索および構造活性相関の解明を目標に研究を実施し、目標を達成することができたので報告する。 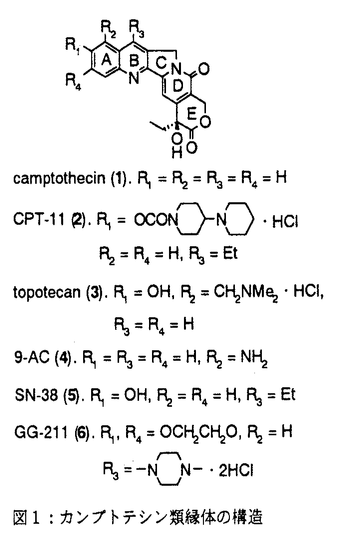 図1:カンプトテシン類縁体の構造1)A,B,C環を変換及び置換基を導入したカンプトテシン類縁体の合成と、その抗腫瘍活性 図1:カンプトテシン類縁体の構造1)A,B,C環を変換及び置換基を導入したカンプトテシン類縁体の合成と、その抗腫瘍活性 始めに、カンプトテシン類縁体の構造活性相関を調査した。その結果、カンプトテシンは、A、B、C、DおよびEの5つの環から構成されるが、D環とE環は抗細胞活性に必須であるが、A環、B環とC環およびその環の近傍には変換による活性向上の可能性があることが判明した。そこで、A、BおよびC環を変換および置換基を導入した11化合物を合成した(スキーム1)。 既知の3環性のケトン7a(RS)から、様々なアミノアルデヒドとの酸性条件下のフリードレンダー反応により、A環部分にピラジン、ピリジンあるいはインダゾールを有するカンプトテシン類縁体を合成した。また、7aから合成したエナミノン8と、芳香族アミンとの反応によりA環としてピラゾールあるいはピリミジンを有する化合物を得た。B環をピラジンに変換した化合物10は、7aから容易に得られたジブロモ体9とジアミノベンゼンとの反応により得た。B環がピロールである化合物12の合成にはFischerのインドール合成法を応用し、フェニルヒドラジンと7aから得られた11を酸存在下加熱し12を合成した。 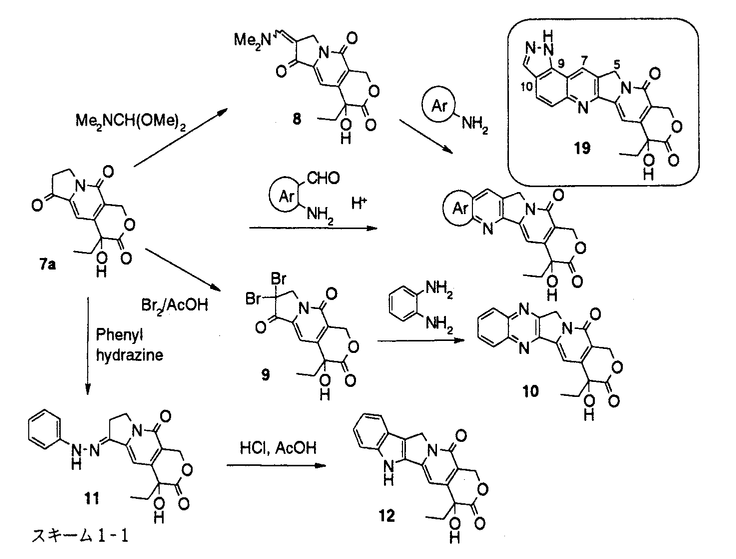 スキーム1-1 スキーム1-1 カンプトテシンでは5員環であるC環を、6員環にしたC-homo-camptothecin16は、3環性ケトン7aの合成中間体13から3環性ケトン14を得、アミノイミン15とのフリードレンダー反応により合成した。また、C環にethylidene基を導入した化合物18は、カンプトテシンの5位にアセチル基を導入後、還元、脱水、脱保護して得た。 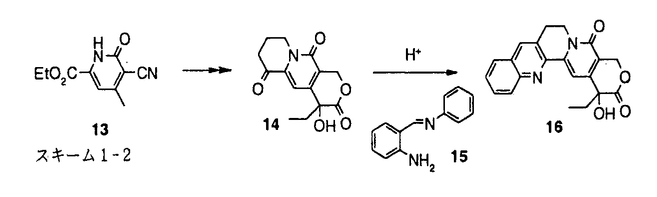 スキーム1-2 スキーム1-2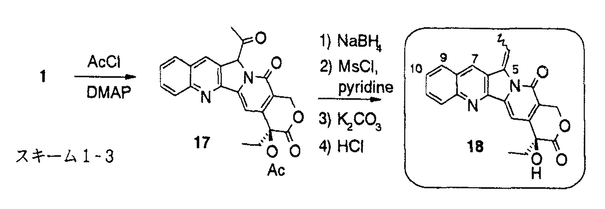 スキーム1-3 スキーム1-3 合成した化合物の癌細胞に対するin vitro抗細胞活性およびマウスにおけるin vivo抗腫瘍効果を測定した。A環部分を欠損、あるいは複素芳香環に変換した化合物、またB環を5員環あるいはC環を6員環に変換した化合物はカンプトテシンに比べ、抗細胞活性が若干ないし大幅に減弱した。一方、カンプトテシン母核を有し、A環上9、10位に環を付加した化合物19およびC環上5位にエチリデン基を有する化合物18には、カンプトテシンと同等以上の抗細胞活性があった。化合物18は5位に置換基を有し、同等以上の活性を有した最初の化合物である。また化合物19には、マウスにおいてカンプトテシンを上回るin vivo抗腫瘍効果があった。これらの結果から、カンプトテシンのA、B、C環の骨格自体の変換による活性増強は困難であること、5位あるいは9、10位への厚みのない置換基の導入により、活性の高い類縁体が得られることがわかった。そこで、カンプトテシン骨格は維持することに決め、A、B環上の7位と9位への置換基の導入により活性の向上を図った。 2)6環性化合物の獲得と、F環の活性に与える影響 これまでほとんど報告例の無い7,9-ジ置換カンプトテシン類縁体、および、カンプトテシンの7位と9位の置換基を環化し、F環を有する6環性化合物を14種類合成した(スキーム2)。化合物20から合成したアミノケトン21,22,23を3環性ケトン7a(RS)あるいは7b(S)とのフリードレンダー反応により縮合し、7,9-ジ置換カンプトテシン誘導体24,25,26を得た。側鎖をメタノール分解および酸処理、あるいは加水分解により6環性化合物27,28を得た。他に、2環性アミノケトンを合成し、3環性ケトン7aあるいは7bとのフリードレンダー反応により、9種の6環性化合物に導いた。 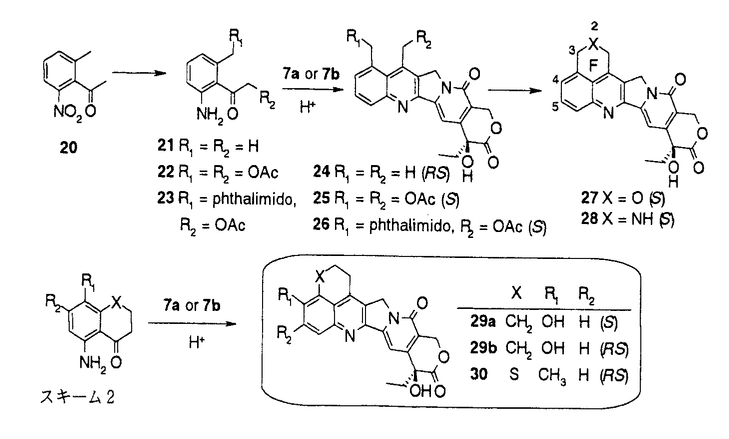 スキーム2 スキーム2 合成した化合物の3種類の癌細胞に対する抗細胞活性と、マウスにおけるin vivo抗腫瘍効果を測定した。その結果、6環性化合物全般に高い抗細胞活性が認められた。新たに付加されたF環として、carbocyclicな5-7員環あるいは、2位あるい3位にヘテロ原子を含む6員環を有する6環性化合物を合成したが、ほとんどの化合物がSN-38(5)を上回る活性を示した。(SN-38はCPT-11(2)の活性代謝物でカンプトテシンの約2倍の抗細胞活性を有している。)なかでも、6環性化合物29aは、SN-38に比べ、約5倍の抗細胞活性を示した。一方、マウスにおけるin vivo抗腫瘍効果においても、測定した6種の6環性化合物いずれも強い効果を示し、特に29bおよび30は対照群に対する生存期間の比率(T/C)が392%以上、テストした6匹中5匹が生存する優れた成績を示した。これらの結果から、6環性化合物は多様なF環において高い抗腫瘍活性があり、リード母核として優れていることがわかった。 3)6環性化合物の詳細な検討 4位および5位の置換基による活性向上を狙い、さらに19種の6環性化合物を合成した。化合物はすべて2環性アミノケトンと3環性ケトン7aあるいは7bとのフリードレンダー反応により合成した。 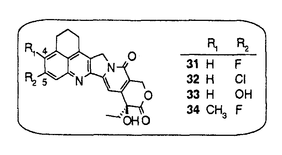 合成した化合物の3種類の癌細胞に対する抗細胞活性とトポイソメラーゼI阻害活性を測定した。抗細胞活性およびトポイソメラーゼIの阻害活性において、5位の置換基のなかで、メチル基は活性を下げる一方、フルオロ基、クロル基、水酸基を有する化合物31,32,33は高い活性を示し、特に、4位にメチル基、5位にフルオロ基を有する34はSN-38の10倍以上の抗細胞活性を示した。化合物の抗細胞活性とトポイソメラーゼ阻害活性の間には、相関係数が0.8以上と良好な相関が認められ、6環性化合物の抗細胞活性はカンプトテシンと同じくトポイソメラーゼIの阻害に基づくことが、確認された。 4)結論 カンプトテシンのA、BおよびC環の変換、あるいは置換基の導入により、カンプトテシンのA、BおよびCの3つの環は活性発現に非常に重要であることを確認し、5位は置換に適した場所であることを初めて見出した。配座の固定した置換基が有利であるとの予想に基き、7位と9位を結んだ6環性化合物を合成した。6環性化合物は、in vitroおよびin vivo抗腫瘍試験において優れた効果を示し、また、その強い活性は、様々な種類のF環において維持され、リード母核として好適な性質を有していることがわかった。なかでも、29bと30はin vivo assayにおいてT/Cが392%以上という強い抗腫瘍効果を示した。さらに、4位および5位の置換基効果に関する検討を行い、5位へのフッソ原子等の導入により活性がさらに数倍上昇することを見い出し、SN-38に比べ10倍以上強い抗細胞活性を有する34を得た。現在、化合物34はさらに改良が加えられ、1位にアミノ基を導入し塩として水溶性を有するDX-8951の抗腫瘍薬としての臨床治験が実施されている。 |