| [緒言] cationic liposomeを用いたcystic fibrosis(CF)の遺伝子治療の問題点の一つは効率の低さである。cystic fibrosis肺病変に対して遺伝子治療をするためには、CFTRのcDNAをCF患者の分化した気道上皮に発現させなくてはいけない。しかし、分化した気道上皮における遺伝子導入の律速段階の研究は行われていない。 我々はこの点を明らかにするため、分化度の異なる細胞を同時に含んだ気道上皮の初代培養系を作成した。脱分化から再分化の中間において、気道上皮細胞は島状に分布し、辺縁細胞は低分化細胞の特徴を有し、中央の細胞はtight junctionに囲まれ、極性を有し、分化を開始している。 この研究において最初はヒトとラットの気道上皮を用いてリポゾームDNA複合体による形質導入効率を調べたが、その後は安定して培養しやすいラットの気道上皮に焦点を絞り、低分化細胞がなぜ分化した細胞に比べて形質導入効率が良いのかについて調べた。 [方法] ヒト気管支上皮細胞の培養には、肺移植の際に、donorの組織の一部を採取し、気道上皮細胞を分離した。分離された細胞をプレートし、LHC9をベースにした培養液で培養すると、培養細胞は島状の分布を形成し、5日目にリポゾーム-DNA複合体による形質導入の実験を行った。また、ラット気管上皮(RTE)細胞の分離と培養には雄のフィッシャーラットを用い、気管上皮細胞を単離し、Transwell Colにプレートし、培養5日目に膜の50-70%が細胞に覆われた時点で実験を行った。 RTE細胞の形態を電子顕微鏡像および、光学顕微鏡によるアクチンフィラメントの染色により観察した。プラスミドDNAはpCMVCFTRを用い、LipofectAceとともに混合してリポゾームDNA複合体を作成し、必要に応じてBOBO-1とCM-DiI(0.1mg/ml in ethanol)により、二重染色を行った。 リポゾームDNA複合体によるトランスフェクションにはpCMV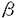 プラスミドとリポゾームを重量比で1:5に混合して用い、37℃で3時間培養し、その後48時間37℃で培養した後、5-bromo-4-chloro-3-indolyl- プラスミドとリポゾームを重量比で1:5に混合して用い、37℃で3時間培養し、その後48時間37℃で培養した後、5-bromo-4-chloro-3-indolyl-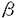 -D-galactoside(X-gal)をもちいて発色した。 -D-galactoside(X-gal)をもちいて発色した。 リポゾームDNA複合体の結合のみを測定するため、4℃あるいは代謝阻害剤の存在下で、リポゾームDNA複合体を培養細胞に加え、結合量を測定した。また、結合とエントリーの総量を測定するため、37℃で3時間培養後、同様に蛍光の量を測定した。また、増殖細胞の同定にはBrdUを用いてDNA合成中の細胞をラベルした。細胞表面の陰性電荷の量の定量にはCationized Ferritinの結合量を測定する方法を用いた。 エンドサイトーシス活性を測定するため、10nmの蛍光Microsphere(Pinocytosis)、2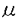 mの蛍光Microsphere(Phagocytosis)、DiIでラベルされたlow density lipoprotein(DiI-LDL)(Rceptor-mediated Endocytosis)を用いた。これらのマーカーは37℃で3時間培養され、蛍光の強度を測定した。 mの蛍光Microsphere(Phagocytosis)、DiIでラベルされたlow density lipoprotein(DiI-LDL)(Rceptor-mediated Endocytosis)を用いた。これらのマーカーは37℃で3時間培養され、蛍光の強度を測定した。 低分化細胞におけるリポゾームDNA複合体の侵入経路を測定するため、RTE細胞をサイトカラシンB(PinocytosisとPhagocytosisは阻害するが、Rceptor-mediated Endocytosisは阻害しない)で前処置した後、37℃で3時間、リポゾームDNA複合体と培養し、蛍光の強度でエンドサイトーシス活性を測定した。さらに、PinocytosisとPhagocytosisを区別するため、カリウム欠乏状態でエンドサイトーシス活性を測定した。 [結果] 培養5日目のヒト気道上皮細胞とRTE細胞をリポゾームDNA複合体でトランスフェクトし、X-galで発色した。LacZ発現細胞は島状に分布した細胞の辺縁に主に分布し、中央の細胞は形質導入効率が悪い(縁細胞では4%±1.1%、中央の細胞で0.2%±0.2%)。 電子顕微鏡によるRTE細胞の形態学的特徴としては、中央の細胞はTight Junctionに囲まれ、Microvilliや繊毛、glycocalyxを持つものもあった。辺縁の細胞は、表面が平滑で明らかな極性は見られなかった。つづいて、phalloidinを用いてF-actinの染色を行った。中央の細胞はF-actinが細胞膜の側面に沿って存在する(Perijunctional actin filament)。一方で、辺縁の細胞はlamellipodiaやfilopodiaを持ち、wound healing cellと類似する。 細胞の増殖と形質導入効率の関係を調べるために、培養5日目のRTE細胞でBrdUの取り込みをしらべた。BrdU陽性細胞は島状の細胞隗全体に分布し、辺縁細胞のほうが形質導入効率が高い理由としては細胞増殖の程度とは無関係であると考えられた。 CM-DiIでラベルされたリポゾームDNA複合体を4℃あるいは37℃でRTE細胞と培養して、結合とエントリーをそれぞれ定量した。蛍光ラベルされたリポゾームDNA複合体は4℃でも37℃でも辺縁細胞に集中してみられ、辺縁細胞に選択的に結合し、細胞内に入ることがわかった。中央の細胞では有意な量の蛍光は認められなかった。 リポゾームDNA複合体の辺縁細胞への選択的結合が細胞表面の陰性電荷の増加によるのかを調べるため、cationized ferritinを用いて、辺縁細胞と中央の細胞とで細胞表面の陰性電荷に違いがあるかどうか調べた。cationized ferritinは辺縁細胞に選択的に結合し、辺縁細胞は中央の細胞より細胞表面の陰性電荷が多いことが示唆された。定量によっても、中央の細胞の蛍光の強度は辺縁細胞の約10%であり、分化段階が進むことにより、気道上皮細胞の陰性電荷は減少した。 辺縁細胞と中央の細胞とで、Pinocytosis、Phagocytosis、receptor-mediated endocytosisの測定を行った。pinocytosisとphagocytosisは辺縁細胞に選択的に認められた。それに対して、receptor-mediated endocytosisは辺縁細胞のみでなく中央の細胞にもみとめられた。 エンドサイトーシスのマーカー3種類と蛍光ラベルしたリポゾームDNA複合体を5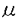 g/mlのサイトカラシンBの存在下でRTE細胞と培養した。サイトカラシンBはpinocytosisを65%とphagocytosisを93%阻害したが、receptor-mediated endocytosisを阻害しなかった。同濃度のサイトカラシンBは蛍光ラベルしたリポゾームDNA複合体のエントリーを50%阻害した。この事より、リポゾームDNA複合体のエントリーにはpinocytosisかphagocytosisが必要と考えられた。 g/mlのサイトカラシンBの存在下でRTE細胞と培養した。サイトカラシンBはpinocytosisを65%とphagocytosisを93%阻害したが、receptor-mediated endocytosisを阻害しなかった。同濃度のサイトカラシンBは蛍光ラベルしたリポゾームDNA複合体のエントリーを50%阻害した。この事より、リポゾームDNA複合体のエントリーにはpinocytosisかphagocytosisが必要と考えられた。 つづいて、細胞内のカリウム欠乏が、pinocytosisに影響なく、phagocytosisを阻害するのではないかと考え、リポゾームDNA複合体の侵入経路がpinocytosisかphagocytosisかを区別するための実験を行った。カリウム欠乏状態のRTE細胞をpinocytosisおよびphagocytosisのマーカーと培養すると、phagocytosisは90%以上阻害されたが、pinocytosisは影響を受けなかった。さらに、カリウム欠乏はリポゾームDNA複合体のエントリーを71%阻害した。このことより、phagocytosisがリポゾームDNA複合体の主たる侵入経路であることが示唆された。 [考案] cationic liposomeを用いてCFに対する遺伝子治療を行うにはさらに効率の良いベクターの開発が必要である。ヒトで報告された遺伝子治療の結果は満足の行くものではない。気道上皮への形質導入効率を上げるため、我々は、形質導入効率の高い低分化細胞と形質導入効率の低い分化した細胞とで、リポゾームDNA複合体の細胞表面への結合と細胞内への侵入経路においてどのような差があるかを検討した。 今回我々が用いたのは、分化段階の異なる気道上皮細胞が同時に存在する培養系である。ヒトとラットの系でどちらも同じ形質導入のパターンが見られたことから、リポゾームDNA複合体を用いた遺伝子導入の律速段階としては同じメカニズムが働いていることが示唆された。 形態学的特徴を調べたところ、辺縁細胞は中央細胞より低分化であるといえる。そこで我々はこの段階の辺縁細胞と中央細胞とを比較することで、分化段階の違いによる形質導入効率の相違を研究することとした。 まず、細胞増殖がリポゾームDNA複合体による形質導入効率と相関するという報告があるので、まず、増殖の速い細胞の分布を調べた結果、DNA合成の盛んな増殖の速い細胞は島状の細胞全体に分布していた。細胞増殖は辺縁と中央での形質導入効率の違いを説明できるものではなかった。 次に我々は、リポゾームDNA複合体の細胞表面への結合と、細胞内へのエントリーを辺縁細胞と中央の細胞とで比較した。ラベルされたリポゾームDNA複合体をRTE細胞と培養すると、ほとんどすべての辺縁細胞はリポゾームDNA複合体を取り込み、これらの細胞での選択的形質導入パターンと一致した。そこで今度は、4℃でリポゾームDNA複合体の細胞表面への結合を調べ、さらにcationized ferritinを用いて、細胞表面の陰性電荷を測定した。リポゾームDNA複合体もcationized ferritinも辺縁細胞に選択的に結合が認められた。細胞表面の陰性荷電がリポゾームを細胞表面に集めて保持することによりリポゾームDNA複合体がより多く細胞内に取り込まれると考えられた。 細胞表面への結合の低下のみが分化した細胞でのリポゾームDNA複合体の取り込みの低下の原因かどうかを調べるため、辺縁細胞と中央の細胞とでエンドサイトーシスの経路にどのような違いがあるかを調べ、辺縁細胞ではどの経路を用いてリポゾームDNA複合体の取り込みが行われているのかを調べた。辺縁細胞はどのマーカーもよく取り込んだが、中央の細胞はreceptor-mediated endocytosisのみを有意に認め、pinocytosisやphagocytosisは認めなかった(図7)。 リポゾームDNA複合体の辺縁細胞への侵入経路を調べるため、サイトカラシンBでpinocytosisとphagocytosisをブロックし、リポゾームDNA複合体の取り込みに与える影響を調べた。サイトカラシンBはpinocytosisとphagocytosisをブロックしたが、receptor-mediated endocytosisは阻害しなかった。これと同濃度のサイトカラシンBはリポゾームDNA複合体の取り込みを50%阻害したことから、リポゾームDNA複合体の取り込みにはpinocytosisかphagocytosisが必要であると考えられた。 次に、pinocytosisとphagocytosisを区別するために、細胞内のK+を欠乏させた条件でpinocytosisとphagocytosisがどのように阻害されるかを調べた。K+欠乏はpinocytosisは阻害しないがphagocytosisを90%以上阻害した。この条件により、リポゾームDNA複合体の取り込みは71%阻害され、phagocytosisがおもな侵入経路であると考えられた。 結論として、島状に分布した気道上皮細胞は様々な分化段階を示し、そのことが形質導入効率と関係あった。低分化な辺縁細胞は形質導入を受けやすく、それは、陰性電荷が多いことと、phagocytosis活性を持つことによる。島状の細胞分布の中央の細胞は比較的分化度が高く、陰性電荷が少なく、phagocytosis活性を持たないため、リポゾームDNA複合体を取り込むことができない。これらのことは、ヒト気道上皮についても言え、さらに、治験段階の他のリポゾームについても同様のことが言える。これらの障害を乗り越えるには、receptor-mediated endocytosisを利用するか、膜癒合を介して細胞内に進入するvirosomeの様なものの開発が必要である。 |