細胞接着分子セレクチンを介した、白血球と血管内皮細胞の接着は、白血球が炎症部位へ浸潤、集積する初期過程の"ローリング"現象を誘導する。セレクチンには、構造的に類似したE-、P-、L-セレクチンの3種類が知られ、いずれもsialyl Lewis x[sLex(1)]様糖鎖をリガンドとして認識する。ところで、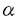 1,3-フコース転移酵素は、GDP-フコースからN-アセチルグルコサミンへ、フコースを 1,3-フコース転移酵素は、GDP-フコースからN-アセチルグルコサミンへ、フコースを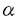 1,3結合で転移する酵素で、sLex様糖鎖の生合成の最終段階に関与する。これまでに5種(Fuc-TIII、Fuc-TIV、Fuc-TV、Fuc-TVI、Fuc-TVII)が報告されているが、そのうちFuc-TVIIは、白血球上のセレクチンリガンドの生合成に関与することが示されている。その一例として、Fuc-TVIIを欠損したマウスでは、白血球のローリングや炎症部位への浸潤が有意に減少する。したがって、Fuc-TVIIを阻害する薬剤は、白血球上のセレクチンリガンドの発現を抑制し、セレクチンを介した白血球と血管内皮細胞の接着を抑制できる抗炎症剤への応用が期待される。このように、Fuc-TVIIの生理的機能については、多くの知見が得られているにもかかわらず、その酵素学的性質については、ほとんど研究されていない。Fuc-TVIIの酵素学的性質を解明することにより、その生理的機能をより詳細に解析できるばかりでなく、Fuc-TVIIの選択的な阻害剤を探索する際に有用な情報を得ることができる。 1,3結合で転移する酵素で、sLex様糖鎖の生合成の最終段階に関与する。これまでに5種(Fuc-TIII、Fuc-TIV、Fuc-TV、Fuc-TVI、Fuc-TVII)が報告されているが、そのうちFuc-TVIIは、白血球上のセレクチンリガンドの生合成に関与することが示されている。その一例として、Fuc-TVIIを欠損したマウスでは、白血球のローリングや炎症部位への浸潤が有意に減少する。したがって、Fuc-TVIIを阻害する薬剤は、白血球上のセレクチンリガンドの発現を抑制し、セレクチンを介した白血球と血管内皮細胞の接着を抑制できる抗炎症剤への応用が期待される。このように、Fuc-TVIIの生理的機能については、多くの知見が得られているにもかかわらず、その酵素学的性質については、ほとんど研究されていない。Fuc-TVIIの酵素学的性質を解明することにより、その生理的機能をより詳細に解析できるばかりでなく、Fuc-TVIIの選択的な阻害剤を探索する際に有用な情報を得ることができる。 このような状況のもとで本研究では、ヒトB細胞リンパ腫細胞株Namalwa KJM-1に発現させた可溶型酵素を、分離・精製して得られたFuc-TVIIの酵素学的性質を詳細に検討解析するとともに、放線菌から発見されたFuc-TVII阻害物質、パノシアリン類の作用を検討して、抗炎症剤などの医薬開発における基礎的な知見を集積することを目的とした。その概要は、以下の通りである。 1.Fuc-TVIIの酵素学的性質の解析 ヒトB細胞リンパ腫細胞株Namalwa KJM-1に、プロテインAとの結合型として発現させた可溶型Fuc-TVIIを、IgG-セファロースを用いたカラムクロマトグラフィーにより精製した。得られたFuc-TVIIは、25mMのMn2+存在下、pH7.5付近で最も高い酵素活性を示し、GDP-フコース(糖供与体基質)と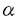 2,3-シアリルラクト-N-ネオテトラオース(糖受容体基質)に対して、それぞれ16.4 2,3-シアリルラクト-N-ネオテトラオース(糖受容体基質)に対して、それぞれ16.4 Mおよび3.08mMのKm値を示した。また、GDP-フコースのリン酸化グアノシン部位に対して高い供与体選択性を示し、その熱安定性は、ポリエチレングリコール存在下で顕著に増加することが判明した。さらに、 Mおよび3.08mMのKm値を示した。また、GDP-フコースのリン酸化グアノシン部位に対して高い供与体選択性を示し、その熱安定性は、ポリエチレングリコール存在下で顕著に増加することが判明した。さらに、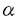 1,3-フコース転移酵素の分類法の一つである、N-エチルマレイミドに対する感受性を基準にして解析したところ、Fuc-TVIIはN-エチルマレイミド耐性群に分類された。 1,3-フコース転移酵素の分類法の一つである、N-エチルマレイミドに対する感受性を基準にして解析したところ、Fuc-TVIIはN-エチルマレイミド耐性群に分類された。  2.Fuc-TVIIの受容体に対する認識様式 Fuc-TVIIは、他の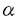 1,3-フコース転移酵素とは異なり、 1,3-フコース転移酵素とは異なり、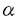 2,3結合でシアル酸が結合した2型の糖鎖だけを受容体とする。Fuc-TVIIの受容体に対する特異性をさらに詳細に解析するために、受容体の類縁体21種を用いて、Fuc-TVIIの受容体認識の様式を検討した。その結果、Fuc-TVIIの受容体認識には、受容体中のガラクトース残基の4位の水酸基、N-アセチルグルコサミン残基の3位の水酸基および2位のカルボニルアミノ基が必須であることが判明した。一方、Fuc-TVIIのアイソザイムであるFuc-TVIでは、N-アセチルグルコサミン残基の2位のカルボニルアミノ基のみが必須であった。これらの結果から、Fuc-TVIIとFuc-TVIは、同じ受容体を認識するにもかかわらず、その認識様式は異なっていると考えられた。 2,3結合でシアル酸が結合した2型の糖鎖だけを受容体とする。Fuc-TVIIの受容体に対する特異性をさらに詳細に解析するために、受容体の類縁体21種を用いて、Fuc-TVIIの受容体認識の様式を検討した。その結果、Fuc-TVIIの受容体認識には、受容体中のガラクトース残基の4位の水酸基、N-アセチルグルコサミン残基の3位の水酸基および2位のカルボニルアミノ基が必須であることが判明した。一方、Fuc-TVIIのアイソザイムであるFuc-TVIでは、N-アセチルグルコサミン残基の2位のカルボニルアミノ基のみが必須であった。これらの結果から、Fuc-TVIIとFuc-TVIは、同じ受容体を認識するにもかかわらず、その認識様式は異なっていると考えられた。 なお、上記の21種の類縁体中、N-アセチルグルコサミン残基の6位の水酸基を還元した化合物と、シアル酸残基のアセタミド基をグリコリルアミノ基に置換した化合物は、親化合物よりも高いFuc-TVII親和性を示した。マススペクトルによる解析の結果、これらの化合物は、Fuc-TVIIによりフコースの転移を受ける受容体であることが確認された。  3.硫酸化sLex前駆体に対するFuc-TVIIの基質特異性 3種類のセレクチンの中で、L-セレクチンは、硫酸化sLex様糖鎖[ガラクトース残基の6位が硫酸化された6-硫酸化sLex(2)、N-アセチルグルコサミン残基の6位が硫酸化された6’-硫酸化sLex(3)、およびガラクトース残基とN-アセチルグルコサミン残基の両方の6位が硫酸化された6,6’-硫酸化sLex(4)]をリガンドとする。特に、6-硫酸化sLexは、L-セレクチンのリガンドとして、ヒト高内皮静脈に発現していることが報告されている。しかし、これらのL-セレクチンリガンドの生合成経路は、明らかにされていない。そこで、これら3種類の硫酸化sLexの前駆体に対するFuc-TVIIの基質特異性を検討することにより、L-セレクチンのリガンドの生合成経路の推定を試みた。その結果、6-硫酸化sLexの前駆体は、sLexの前駆体よりも高いFuc-TVII親和性を示したことから、6-硫酸化sLexは、sLexの前駆体が硫酸化された後に、Fuc-TVIIによりフコースの転移を受けて合成されると推測された。一方、6’-硫酸化sLexや6,6’-硫酸化sLexの前駆体は、Fuc-TVIIに認識されなかった。したがって、6’-硫酸化sLexおよび6,6’-硫酸化sLexは、6-硫酸化sLexとは異なり、sLexが合成された後に硫酸化されて合成されると推測された。 4.パノシアリン類によるU937細胞上のセレクチンリガンド発現の抑制 Fuc-TVIIの阻害剤は、抗炎症剤としての可能性を有することから、酵素学的性質の解明と同時に、Fuc-TVIIの阻害剤の探索を行った。微生物の代謝産物を対象にした阻害剤のスクリーニングにおいて、Streptomyces属の放線菌KY11789株の培養液に、顕著なFuc-TVII阻害活性を検出した。そこで阻害活性を指標に、KY11789株の培養液から活性物質の単離を試みたところ、パノシアリンA(5)およびB(6)を得ることができた。パノシアリンAおよびBは、それぞれIC50値4.8および5.3 g/mLでFuc-TVIIを阻害した。一方、Fuc-TVIIのアイソザイムであるFuc-TVIに対する両化合物のIC50値は、それぞれ28.7および30.1 g/mLでFuc-TVIIを阻害した。一方、Fuc-TVIIのアイソザイムであるFuc-TVIに対する両化合物のIC50値は、それぞれ28.7および30.1 g/mLであったことから、これらは、Fuc-TVIIに選択的な阻害剤であると考えられた。また、パノシアリンAは、ヒト血球系細胞株U937上のE-セレクチンリガンド、P-セレクチンリガンド、sLexの発現を抑制した。さらに、9種類の抗体で検出されるガングリオシドおよび7種類のレクチンで検出される糖鎖および細胞表面のタンパク抗原の発現にはほとんど影響を与えなかったことから、パノシアリンAは、セレクチンリガンドの発現を選択的に抑制すると考えられた。なお、パノシアリンAは、U937細胞のE-セレクチンキメラ分子への接着も阻害した。これらの結果は、糖転移酵素の阻害剤が、細胞表面の糖鎖の発現を変化させた初めての例であるとともに、Fuc-TVIIの阻害剤が、セレクチンリガンドの発現を選択的に抑制する抗炎症剤としての可能性を示した例として注目された。 g/mLであったことから、これらは、Fuc-TVIIに選択的な阻害剤であると考えられた。また、パノシアリンAは、ヒト血球系細胞株U937上のE-セレクチンリガンド、P-セレクチンリガンド、sLexの発現を抑制した。さらに、9種類の抗体で検出されるガングリオシドおよび7種類のレクチンで検出される糖鎖および細胞表面のタンパク抗原の発現にはほとんど影響を与えなかったことから、パノシアリンAは、セレクチンリガンドの発現を選択的に抑制すると考えられた。なお、パノシアリンAは、U937細胞のE-セレクチンキメラ分子への接着も阻害した。これらの結果は、糖転移酵素の阻害剤が、細胞表面の糖鎖の発現を変化させた初めての例であるとともに、Fuc-TVIIの阻害剤が、セレクチンリガンドの発現を選択的に抑制する抗炎症剤としての可能性を示した例として注目された。  以上、本研究は、白血球上のセレクチンリガンドの生合成に関与するFuc-TVIIの酵素学的性質を明らかにするとともに、受容体の類縁化合物を用いて、Fuc-TVIIの受容体特異性を詳細に検討し、Fuc-TVIIとFuc-TVIが異なった様式で受容体を認識することを明らかにした。また、L-セレクチンのリガンドである硫酸化sLexの前駆体に対するFuc-TVIIの基質特異性を検討し、L-セレクチンリガンドの生合成経路を推定した。また、放線菌から単離したFuc-TVII阻害剤のパノシアリン類が、細胞表面のセレクチンリガンドの発現を選択的に抑制することを明らかにした。これらの結果は、Fuc-TVIIの阻害剤が、抗炎症剤として有望であることを示すとともに、Fuc-TVIIの選択的な阻害剤の探索において、有用な情報を提供すると考えられる。さらに、Fuc-TVIIを有用糖鎖の合成へ応用する途も拓けた。 |