酵素は一般に高い基質特異性を有し、基質を厳密に認識してその化学反応を触媒する。アミノ酸配列の相同性を持つ一群の酵素であっても、1つ1つの酵素の基質特異性を詳細に解析すると、互いに微妙に、しかし明らかに異なる基質特異性をもつ酵素が数多く存在する。本研究では、Thermoactinomyces vulgaris R-47の生産する -アミラーゼTVAIとEscherichia coli TUH12191の生産する -アミラーゼTVAIとEscherichia coli TUH12191の生産する -ラクタマーゼToho-1を取り上げ、それぞれの基質特異性を決定している要因を蛋白質工学的手法とX線結晶解析により解明した。 -ラクタマーゼToho-1を取り上げ、それぞれの基質特異性を決定している要因を蛋白質工学的手法とX線結晶解析により解明した。 第1章Thermoactinomyces vulgaris R-47の -アミラーゼTVAIの基質特異性の改変 -アミラーゼTVAIの基質特異性の改変  -アミラーゼを含む糖質関連酵素は澱粉加工工業で重要な位置を占めており、異なる基質特異性を持つ酵素が用途に応じて利用されている。多糖プルランを分解する酵素も数多く発見されており、以下のように分類される。(i)プルランの -アミラーゼを含む糖質関連酵素は澱粉加工工業で重要な位置を占めており、異なる基質特異性を持つ酵素が用途に応じて利用されている。多糖プルランを分解する酵素も数多く発見されており、以下のように分類される。(i)プルランの -(1,6)グルコシド結合(Fig.1、linkage1)を加水分解しマルトトリオースを生成する酵素。これには、スターチの -(1,6)グルコシド結合(Fig.1、linkage1)を加水分解しマルトトリオースを生成する酵素。これには、スターチの -(1,6)グルコシド結合を分解するプルラナーゼと、スターチの -(1,6)グルコシド結合を分解するプルラナーゼと、スターチの -(1,4)グルコシド結合を分解して主にマルトースを生成するアミロプルラナーゼの2種類がある。(ii)プルランの -(1,4)グルコシド結合を分解して主にマルトースを生成するアミロプルラナーゼの2種類がある。(ii)プルランの -(1,4)グルコシド結合(Fig.1、linkage2)を分解し、パノースを生成する酵素。(iii)プルランの -(1,4)グルコシド結合(Fig.1、linkage2)を分解し、パノースを生成する酵素。(iii)プルランの -(1,4)グルコシド結合(Fig.1、linkage3)を分解し、イソパノースを生成する酵素。 -(1,4)グルコシド結合(Fig.1、linkage3)を分解し、イソパノースを生成する酵素。  Fig.1 プルランの構造と切断様式 Fig.1 プルランの構造と切断様式 Thermoactinomyces vulgaris R-47の生産する2つの -アミラーゼTVAI、TVAIIは(ii)のグループに分類されるプルラン分解性 -アミラーゼTVAI、TVAIIは(ii)のグループに分類されるプルラン分解性 -アミラーゼである。TVAI、TVAIIの酵素学的性質は似ているが、TVAIはスターチやプルランのような多糖分解能が高いのに対し、TVAIIは低分子オリゴ糖に対する分解能が高いという基質特異性の違いがある。 -アミラーゼである。TVAI、TVAIIの酵素学的性質は似ているが、TVAIはスターチやプルランのような多糖分解能が高いのに対し、TVAIIは低分子オリゴ糖に対する分解能が高いという基質特異性の違いがある。 本研究では特にTVAIの保存領域IIに注目した。プルランを分解しない -アミラーゼ、サイクロデキストリングルカノトランスフェラーゼ(CGTase)とプルラン分解酵素では、保存領域IIのC末端側の配列が大きく異なる(Fig.2a)。プルラン分解酵素の保存領域IIとIIIのアミノ酸配列のさらに詳細なアラインメントを行なったところ、TVAII、ネオプルラナーゼ、アミロプルラナーゼの保存領域IIの後半部分の配列はVANEで共通しているがTVAIにおいてはAAQYとなっており、その上TVAIのみが保存領域IIのC末端側に11残基の余剰配列を持っていることが判明した(Fig.2b)。 -アミラーゼ、サイクロデキストリングルカノトランスフェラーゼ(CGTase)とプルラン分解酵素では、保存領域IIのC末端側の配列が大きく異なる(Fig.2a)。プルラン分解酵素の保存領域IIとIIIのアミノ酸配列のさらに詳細なアラインメントを行なったところ、TVAII、ネオプルラナーゼ、アミロプルラナーゼの保存領域IIの後半部分の配列はVANEで共通しているがTVAIにおいてはAAQYとなっており、その上TVAIのみが保存領域IIのC末端側に11残基の余剰配列を持っていることが判明した(Fig.2b)。  Fig.2 TVAIとその関連酵素の保存領域の比較。(a)TVAIとその関連酵素の保存領域の比較。3つの活性触媒基の位置はアスタリスクで示した。(b)TVAI.TVAII.B.stearothermophilus neopullulanase.T.ethanolicus amylopullulanaseの保存領域IIとIIIのアミノ酸配列の比較。下段には本研究で作製したTVAI変異型酵素の保存領域II、III付近のアミノ酸配列を示した。 Fig.2 TVAIとその関連酵素の保存領域の比較。(a)TVAIとその関連酵素の保存領域の比較。3つの活性触媒基の位置はアスタリスクで示した。(b)TVAI.TVAII.B.stearothermophilus neopullulanase.T.ethanolicus amylopullulanaseの保存領域IIとIIIのアミノ酸配列の比較。下段には本研究で作製したTVAI変異型酵素の保存領域II、III付近のアミノ酸配列を示した。 TVAI特有の保存領域II付近のアミノ酸配列と基質特異性の関係を解析するために、以下のTVAI変異型酵素を作製した。(i)11残基の余剰配列を欠失した変異型酵素Del11;(ii)保存領域後半の357番目から360番目の配列AAQYをTVAII型の配列VANEにした変異型酵素AQY/VNE;(iii)(i)と(ii)の変異を組み合わせたDel11+AQY/VNEである(Fig.2b下段)。速度論的解析の結果、特に大きな基質特異性の変化を示したのは変異型酵素Del11+AQY/VNEであった。変異型酵素Del11+AQY/VNEの -(1,4)グルコシド結合分解能は、スターチ、プルラン、各種マルトオリゴ糖を基質として測定したところ、kcm/Km値で野性型酵素の1/26から1/187と顕著に低下していた。一方、イソパノースを基質とした場合の -(1,4)グルコシド結合分解能は、スターチ、プルラン、各種マルトオリゴ糖を基質として測定したところ、kcm/Km値で野性型酵素の1/26から1/187と顕著に低下していた。一方、イソパノースを基質とした場合の -(1,6)グルコシド結合分解能は、kcm/Km値で野性型酵素の1/2から1/4に変化したに過ぎなかった。TLCで基質の分解パターンを確認したところ、Del11+AQY/VNEによるスターチ分解パターンは野性型TVAIとほぼ同じであったが、プルランを基質にした場合、 -(1,6)グルコシド結合分解能は、kcm/Km値で野性型酵素の1/2から1/4に変化したに過ぎなかった。TLCで基質の分解パターンを確認したところ、Del11+AQY/VNEによるスターチ分解パターンは野性型TVAIとほぼ同じであったが、プルランを基質にした場合、 -(1,6)グルコシド結合を分解してマルトトリオースを生成する傾向が強くなっていることが確認された。これらの結果から、この変異型酵素では -(1,6)グルコシド結合を分解してマルトトリオースを生成する傾向が強くなっていることが確認された。これらの結果から、この変異型酵素では -(1,4)グルコシド結合に対する分解活性だけが特異的に減少しており、全体の活性はネオプルラナーゼ型からアミロプルラナーゼ型に変換されたことが明らかになった。 -(1,4)グルコシド結合に対する分解活性だけが特異的に減少しており、全体の活性はネオプルラナーゼ型からアミロプルラナーゼ型に変換されたことが明らかになった。 第2章基質特異性拡張型 -ラクタマーゼToho-1のX線結晶構造解析 -ラクタマーゼToho-1のX線結晶構造解析  -ラクタム剤は細菌のペプチドグリカン生合成を阻害することで抗菌作用を示すため抗生物質として多用されてきたが、その使用に伴って -ラクタム剤は細菌のペプチドグリカン生合成を阻害することで抗菌作用を示すため抗生物質として多用されてきたが、その使用に伴って -ラクタム剤に耐性を持つ細菌が数多く出現した。これらの耐性菌の耐性獲得機構の1つが、 -ラクタム剤に耐性を持つ細菌が数多く出現した。これらの耐性菌の耐性獲得機構の1つが、 -ラクタム剤を加水分解する酵素 -ラクタム剤を加水分解する酵素 -ラクタマーゼの生産である。医薬の分野で数多く開発された -ラクタマーゼの生産である。医薬の分野で数多く開発された -ラクタム剤のうち、第三世代セフェム系抗生物質は -ラクタム剤のうち、第三世代セフェム系抗生物質は -ラクタマーゼに分解されにくいことから現在頻繁に用いられている。しかし、これらに対しても耐性を示す細菌の存在が最近相次いで報告されており、第三世代セフェム系抗生物質耐性菌が生産するクラスA酵素は基質特異性拡張型 -ラクタマーゼに分解されにくいことから現在頻繁に用いられている。しかし、これらに対しても耐性を示す細菌の存在が最近相次いで報告されており、第三世代セフェム系抗生物質耐性菌が生産するクラスA酵素は基質特異性拡張型 -ラクタマーゼ(ESBL)と呼ばれている。 -ラクタマーゼ(ESBL)と呼ばれている。 Toho-1は大腸菌TUH12191が生産するESBLである。本研究ではToho-1の基質特異性拡張機構を立体構造の面から解析することを目的として、Toho-1のX線結晶構造解析を行った。Toho-1野性型酵素は解析に不向きな双晶を形成する傾向が強かったため、解析には166番目のGluをAlaに置換した変異型酵素E166Aの結晶を用いた。X線回折データの収集は筑波の高エネルギー加速器研究機構のワイセンベルグカメラを用いて行い、空間群はP3221、格子定数はa=b=73.3Å、c=99.4Å、 = = =90°、 =90°、 =120°と求められた。Bacillus licheniformis =120°と求められた。Bacillus licheniformis  -ラクタマーゼをモデルとして分子置換法により位相を決定し、最終的に1.8-6.0Åのデータを用いてR値が18.2%、Rfree値が21.7%となった。この結晶構造は、ESBLでは初めてのものである。 -ラクタマーゼをモデルとして分子置換法により位相を決定し、最終的に1.8-6.0Åのデータを用いてR値が18.2%、Rfree値が21.7%となった。この結晶構造は、ESBLでは初めてのものである。 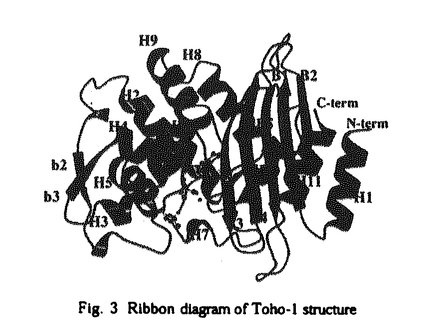 Fig.3 Ribbon diagram of Toho-1 structure Fig.3 Ribbon diagram of Toho-1 structure Toho-1の構造は基質特異性非拡張型 -ラクタマーゼ(non-ESBL)の構造と同様2つのドメインから構成され、ドメインの間に活性中心が位置する(Fig.3)。Toho-1は比較的大きな置換基をもつ第三世代セフェム系抗生物質を分解することから、触媒部位がnon-ESBLよりも広いか、あるいはドメイン間や活性触媒部位構成要素のflexibilityが高いのではないかと考えられてきた。しかし構造解析の結果、Toho-1活性部位のクレフトの広さはnon-ESBLと同程度であった。 -ラクタマーゼ(non-ESBL)の構造と同様2つのドメインから構成され、ドメインの間に活性中心が位置する(Fig.3)。Toho-1は比較的大きな置換基をもつ第三世代セフェム系抗生物質を分解することから、触媒部位がnon-ESBLよりも広いか、あるいはドメイン間や活性触媒部位構成要素のflexibilityが高いのではないかと考えられてきた。しかし構造解析の結果、Toho-1活性部位のクレフトの広さはnon-ESBLと同程度であった。 活性中心付近を詳細に解析すると、Toho-1の基質特異性拡張の要因と考えられる点がいくつか挙げられた。まず、これまでも基質特異性拡張のカギとなるとされてきた残基Ser237の側鎖は活性部位の中心を向き、活性中心にある硫酸イオンと水素結合していた。これは、この残基が基質結合に直接関与していることを示唆する結果である。他に興味深い点としてArg残基の配置が挙げられる。non-ESBLでは244番目のArg残基が高度に保存されており、このArg側鎖が水分子を介して -ラクタム剤と結合するとされているが、Toho-1を含む一群のESBLにおいては244位はThrである。その代わり、Toho-1ではnon-ESBLにおいてArg244の側鎖が占める位置付近にArg276の側鎖が存在していた。このことから、Toho-1ではArg276がnon-ESBLのArg244の代替として働く可能性が考えられる。ESBLの276位にはArg、あるいはLysが保存されていることから、プラス電荷を持つアミノ酸(Arg/Lys)の位置の違いが、基質特異性の違いの一因ではないかと想像される。 -ラクタム剤と結合するとされているが、Toho-1を含む一群のESBLにおいては244位はThrである。その代わり、Toho-1ではnon-ESBLにおいてArg244の側鎖が占める位置付近にArg276の側鎖が存在していた。このことから、Toho-1ではArg276がnon-ESBLのArg244の代替として働く可能性が考えられる。ESBLの276位にはArg、あるいはLysが保存されていることから、プラス電荷を持つアミノ酸(Arg/Lys)の位置の違いが、基質特異性の違いの一因ではないかと想像される。 Toho-1において触媒部位構成要素の -ストランドB3と -ストランドB3と ループが高いflexibilityを有する可能性を示唆する構造的特徴も見られた。Toho-1とB.licheniformis ループが高いflexibilityを有する可能性を示唆する構造的特徴も見られた。Toho-1とB.licheniformis -ラクタマーゼの構造を比較すると、Toho-1では -ラクタマーゼの構造を比較すると、Toho-1では ループ上の170位付近と ループ上の170位付近と -ストランドB3のC末端の間での水素結合が少ない。また、non-ESBLでは160位のThr残基と181位のSer/Thr残基が保存され水素結合しているが、Toho-1や他のESBLでは160位はPhe残基で保存されており、水素結合は形成されない。さらに、Toho-1などのESBLは -ストランドB3のC末端の間での水素結合が少ない。また、non-ESBLでは160位のThr残基と181位のSer/Thr残基が保存され水素結合しているが、Toho-1や他のESBLでは160位はPhe残基で保存されており、水素結合は形成されない。さらに、Toho-1などのESBLは -ストランドB3上の232位、236位、238位にGly残基を持っている。多くのGly残基が連続して存在することで、 -ストランドB3上の232位、236位、238位にGly残基を持っている。多くのGly残基が連続して存在することで、 -ストランドB3のflexibilityが増している可能性が考えられる。 -ストランドB3のflexibilityが増している可能性が考えられる。 第3章 -ラクタマーゼToho-1の基質特異性の解析 -ラクタマーゼToho-1の基質特異性の解析 Toho-1の立体構造の解析から、活性中心近傍の -ストランドB3および -ストランドB3および ループのflexibilityが第三世代セフェム系抗生物質分解能に関与している可能性が考えられた。そこで本章では ループのflexibilityが第三世代セフェム系抗生物質分解能に関与している可能性が考えられた。そこで本章では -ストランドB3のflexibilityと基質特異性拡張の関係を明らかにすることを目的として、 -ストランドB3のflexibilityと基質特異性拡張の関係を明らかにすることを目的として、 -ストランドB3と -ストランドB3と -ヘリックスH2の間にジスルフィド結合を導入して -ヘリックスH2の間にジスルフィド結合を導入して -ストランドB3を固定することを考えた。 -ストランドB3を固定することを考えた。 Toho-1に存在するCys残基は -ヘリックスH2のN末端に位置するCys69のみである。そこで、 -ヘリックスH2のN末端に位置するCys69のみである。そこで、 ストランドB3上の238位にCys残基を導入してCys69との間にジスルフィド結合を形成するよう、238位のGlyをCysに置換した変異型酵素G238Cを作製した。G238Cではジスルフィド結合が期待したとおりに形成されていた。変異型酵素G238Cはペニシリン系、第一世代セフェム系抗生物質に対しては野性型に近い値を示したが、第三世代セフェム系抗生物質やモノバクタムのアゾトレオナムに対してはVmax/Km値が低くなる傾向が見られた。このことは、 ストランドB3上の238位にCys残基を導入してCys69との間にジスルフィド結合を形成するよう、238位のGlyをCysに置換した変異型酵素G238Cを作製した。G238Cではジスルフィド結合が期待したとおりに形成されていた。変異型酵素G238Cはペニシリン系、第一世代セフェム系抗生物質に対しては野性型に近い値を示したが、第三世代セフェム系抗生物質やモノバクタムのアゾトレオナムに対してはVmax/Km値が低くなる傾向が見られた。このことは、 -ストランドB3の固定によって第三世代セフェム系抗生物質に対する分解能が下がることを示している。 -ストランドB3の固定によって第三世代セフェム系抗生物質に対する分解能が下がることを示している。 |