結果(1)テモカプリラートの肝取り込み機構 血液中から肝臓中への取り込み過程についてラット遊離肝細胞系および有機アニオン輸送担体(oatp1;organic anion transporting polypeptide)発現系を用いて評価した。
遊離肝細胞実験Sprague-Dawley(SD)ラットより、コラゲネース灌流法により遊離肝細胞を調製して検討を行なったところ、テモカプリラートの取り込みは、薬物添加後少なくとも2分までは直線的に増加し、低温下でその取り込みは有意に低下した。さらに代謝阻害剤、SH基修飾試薬により阻害を受けたものの、medium中のNa+をLi+に置換しても影響を受けなかった。またこの取り込みは飽和性を示し、Na+非依存的な有機アニオン輸送担体の代表的基質であるestradiol-17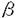 glucuronide(E217
glucuronide(E217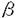 G)やdibromosulfophthaleinにより濃度依存的に阻害を受けた。しかしながらE217
G)やdibromosulfophthaleinにより濃度依存的に阻害を受けた。しかしながらE217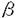 Gによる阻害は部分的であった。これらの結果から、テモカプリラートの肝臓中への取り込みにNa+非依存的な輸送担体が関与していることが示唆された。
Gによる阻害は部分的であった。これらの結果から、テモカプリラートの肝臓中への取り込みにNa+非依存的な輸送担体が関与していることが示唆された。
oatp1発現COS-7細胞実験 oatp1発現系を用いて検討を加えたところ、oatp1によりテモカプリラートの取り込みは有意に増加し、濃度依存性を示した。テモカプリラートの肝取り込みにおけるoatp1の寄与率をE217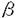 Gを対照化合物として算出すると、0.51となり、oatp1がテモカプリラートの肝臓への取り込みに一部関与していることが示された。この結果は遊離肝細胞を用いた先のE217
Gを対照化合物として算出すると、0.51となり、oatp1がテモカプリラートの肝臓への取り込みに一部関与していることが示された。この結果は遊離肝細胞を用いた先のE217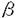 Gによる阻害結果を反映するものであった。
Gによる阻害結果を反映するものであった。
他のACE阻害薬の肝取り込み遊離肝細胞実験、oatp1発現COS-7細胞実験とも、benazaprilat、cilazaprilat、delaprilat、enalaprilatは、[3H]テモカプリラートの肝取り込みを一部阻害し、その程度は、両実験系で良好な相関性を示した。
以上の検討結果から、テモカプリラートの血中から肝臓中への取り込み過程には、Na+非依存的な輸送担体が関与し、oatp1がその一部であることが示された。さらにテモカプリラート以外のACE阻害薬についても肝臓への取り込み過程にoatp1などの輸送担体が関与している可能性が示された。これらの検討結果からは、テモカプリラートと他の尿中排泄型ACE阻害薬との胆汁排泄に関しての差異を説明することができない。そこで次にテモカプリラートの肝臓中から胆汁中への排泄過程について検討を加えた。
(2)テモカプリラートの胆汁排泄機構 canalicular multispecific organic anion transporter(cMOAT)が、遺伝的に欠損しているEisai hyperbilirubinemic rats(EHBR)を用いて種々検討を行なった。
in vivo実験 胆管カテーテルを施したラットにテモカプリルを投与してその体内動態を検討したところ、EHBRにおけるテモカプリラートの胆汁排泄クリアランスは、SDラットの1/20の値となった。この結果より、cMOATがテモカプリラートの胆汁排泄に関与していることが示唆された。
胆管側膜小胞(CMVs)を用いたin vitro輸送実験SDラットCMVsへの[14C]テモカプリラート取り込みは、ATP存在下で直線的に増加するものの、ATP非存在下、およびEHBRのCMVsではそのような増加は見られなかった。さらにこの取り込みは濃度依存性を示した。cMOATの代表的基質であるdinitrophenyl-S-gluthatione(DNP-SG)は濃度依存的に[14C]テモカプリラートの取り込みを阻害し、さらに競合阻害を示した。これらの結果より、テモカプリラートとDNP-SGは一部共通の輸送担体を利用していることが示された。
他のACE阻害薬の胆汁排泄機構benazeprilat、cilazaprilat、delaprilat、enalaprilatは、放射標識テモカプリラートの遊離肝細胞への取り込みに影響を与えたものの、CMVsへの取り込みには影響を与えず、唯一影響を与えたのはテモカプリラートであった。
これらの検討結果から、テモカプリラートの胆汁中への排泄に能動輸送担体cMOATが関与していることが示された一方で、他のACE阻害薬はcMOATへの親和性が低いことが示された。この結果と先の取り込み実験の結果を考慮すると、テモカプリラート以外の尿中排泄型のACE阻害薬についても、肝臓中へは担体輸送により取り込まれているものの、一旦肝臓内へ取り込まれた薬剤の大部分は、肝臓から全身血中へ戻され、結果として、腎臓を介して尿中へ排泄されているものと推察された。一方で肝臓内へ取り込まれたテモカプリラートはcMOATにより効率よく胆汁中へ排泄されていると考えられた。つまり、cMOATへの親和性の違いがテモカプリラートと他のACE阻害薬との排泄挙動の差異を主として説明しているものと考えられた。
(3)有機アニオン性物質の胆汁排泄に関わる能動輸送担体の動物種差 生理学的モデルやアロメトリック式を用いて動物実験からヒトでの体内動態を予想する報告があるものの、胆汁排泄、とりわけそれにかかわる輸送担体の動物種差に関する報告は、ほとんどない。そこでcMOATの動物種差に関して、in vivo、in vitroで検討を行なった。
CMVsを用いたin vitro輸送実験 ラットの方法に準じて各種動物よりCMvsを調製してその評価を行なった。なお、ヒトCMVsの結果は報告を引用した。DNP-SGと胆汁酸輸送担体の基質であるtaurocholateのATP依存的な輸送が確認されたものの、両基質でCMVsへの取り込みに動物種差がみられた。DNP-SG輸送については、いずれの動物でも濃度依存的な輸送を示し、ヒトを除いてkm値がほぼ一定である一方でVmaxはラットにおいて著しく高いことがあきらかとなった。
in vivo実験 胆管にカテーテルを施した各種動物にテモカプリラートを定速静注して体内動態を検討した。ここから胆汁排泄能力のin vivoでの指標である、肝臓中非結合型薬物濃度基準の胆汁排泄クリアランス(CLbile(u,liver))を求め、CMVsよりin vitro実験求められた胆汁排泄能力(DNP-SG輸送のVmax/Km)と比較したところ、両者には良好な相関性がみられた。
これらの検討結果より、動物CMVsを用いたin vitro実験が、in vivoでの胆汁排泄性を反映することが示唆された。このようなスクリーニング系を利用することで、テモカプリラートの胆汁排泄のように、排泄挙動に特徴を持った新薬開発の可能性が考えられた。
結論 (1)テモカプリラートおよび他のACE阻害薬の肝臓中への取り込み過程に輸送担体が関与している。
(2)テモカプリラートの胆汁排泄にのみ、能動輸送担体cMOATが関与している。
これらの結果より、テモカプリラートの良好な胆汁排泄性は肝臓への取り込み過程ではなく、胆汁排泄過程(cMOATの認識性)の違いによることが示された。
(3)膜小胞を用いてin vitroで評価した輸送能力が、in vivoにおける胆汁排泄性を反映したことから、排泄挙動に特徴を持った新薬開発に、CMVs実験を利用するような方法論が考えられた。