| 内容要旨 | | 緒言 小口径人工血管に起因するグラフトの閉塞原因は,一般に吻合部内膜肥厚(以下AIH)であると報告されている.AIHの本態は,血管平滑筋細胞(以下SMC)の過剰な遊走・増殖と細胞外器質の蓄積からなるが,予防策を含め未解決の点も多い.小口径人工血管を用いた血行再建術では,端側吻合を行なうことが多く,末梢側吻合部の血流は解剖学的な理由から両方向性の流れにより構成される乱流になりやすい.このためAIHを検討するためには,両方向性の血流によるずり応力の血管内皮細胞(以下EC)やSMC等に対する影響を検討する必要があると考えられた.またAIH内には,vaso vasorumや内腔由来の新生血管がネットワークを形成することが報告されており,血管新生を標的としたAIH抑制は一つの治療戦略になりうると考えられた.以上から,ずり応力と血管新生という血流の関与する2つの観点から,AIH抑制を検討し,対策を立てることは,臨床上非常に有用であると考えられた. 本研究では以下の3点を目的に検討を行った. 1)両方向性のずり応力のSMCの遊走能・増殖能に対する影響を検討すること. 2)血管新生抑制物質AGM-1470(以下AGM)がSMC自身の遊走・増殖能にどのように作用するか検討し,さらにECを介したSMCの遊走・増殖能にどのように作用するか検討すること. 3)AGMが,in-vivoにおいて局所投与により内膜肥厚抑制に有用であることを確認すること. 対象と方法実験1-1ずり応力下SMC遊走・増殖能 type Iコラーゲンゲルでコートしたdish中央に1辺3mmの方形のSMCのコロニーを作成した.15%FCS加MCDB151培養液(以下MCDB液)を用いてSMCコロニーを培養し,以下の3群作成し,各群のSMCコロニーの進展距離を測定し,遊走能の指標とした.1.静止状態群:静止状態培養した群.2.低ずり応力群:回転式振とう器で,80rpmで円運動させ,平均6dyne/cm2の拍動性ずり応力を負荷して培養した群.3.高ずり応力群:同様に160rpmで円運動させ,平均60dyne/cm2の拍動性ずり応力を負荷して培養した群.またSMCを,前述と同様に静止状態群,低ずり応力群,高ずり応力群の3群作成し培養し,この3群のSMCの増殖能を,MTT assayを用いて検討した. 実験1-2ずり応力下ECを介したSMC遊走・増殖能 ECをMCDB液を用いて,静止状態と160rpmで円運動させてずり応力を負荷した状態で各々培養し,それぞれの上清を採取した.前述のSMCコロニーを用いて以下の4群を作成し,進展距離を測定し,遊走能の指標とした.(a)SMC(static)EC(static)群:静止状態EC上清を用いて,静止状態でSMCを培養した群.(b)SMC(static)EC(sheared)群:ずり応力負荷EC上清を用いて,静止状態でSMCを培養した群.(c)SMC(sheared)EC(static)群:静止状態養EC上清を用いて,160rpmで円運動させてSMCを培養した群.(d)SMC(sheared)EC(sheared)群:ずり応力負荷EC上清を用いて,160rpmで円運動させてSMCを培養した群.同様に,採取した2種類のEC上清を用いて各々SMCを静止状態で培養し,それぞれの増殖能をMTT assayを用いて検討した. 実験2-1ずり応力下EC産生増殖因子 ECをMCDB液を用いて,静止状態で培養した静止群と160rpmで円運動させて培養したずり応力群を作成し,上清を採取した.ずり応力群の上清を用いて,抗PDGF-B抗体10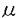 g/mlの濃度に含む培養液と,含まない培養液を作成した.前述のSMCコロニーを用いて,以下の3群を作成し,前述の進展距離を測定した(a)Anti-PDGF(+)群:抗PDGF-B抗体を含む上清を使用した群.(b)Anti-PDGF(-)群:抗PDGF-B抗体を含まない上清を使用した群.(c)静止上清群:静止状態で培養したECの上清を使用した群.またこの3種類の培養上清を用いてSMCを培養し,各群の増殖能をMTT assayを用いて検討した. g/mlの濃度に含む培養液と,含まない培養液を作成した.前述のSMCコロニーを用いて,以下の3群を作成し,前述の進展距離を測定した(a)Anti-PDGF(+)群:抗PDGF-B抗体を含む上清を使用した群.(b)Anti-PDGF(-)群:抗PDGF-B抗体を含まない上清を使用した群.(c)静止上清群:静止状態で培養したECの上清を使用した群.またこの3種類の培養上清を用いてSMCを培養し,各群の増殖能をMTT assayを用いて検討した. 実験2-2AGMのSMC遊走・増殖能に与える影響 MCDB液を用いて,AGMの濃度を0,0.1,1.0,10ng/mlに調整し,この4種類の培養液を用いて4群のSMCコロニーを作成し(AGM(0)群,AGM(0.1)群,AGM(1.0)群,AGM(10)群),各群のSMCコロニーの進展距離を測定した.また各培養液を用いてSMCを培養し,各々の増殖能をMTT assayを用いて検討した. 実験2-3AGMのEC増殖因子産生に対する影響 ECをMCDB液を用いて,以下の3条件で24時間培養し各上清を採取した.(a)静止状態で培養(Non-sheared-EC群).(b)160rpmで円運動したずり応力負荷条件下で培養(Sheared-EC(AGM-)群).(c)AGMを10ng/mlに調整したMCDB液を用いて,160rpmで円運動したずり応力負荷条件下で培養(Sheared-EC(AGM+)群).この3群から採取した3種類の上清のうち,(b)で採取した上清のみ,AGMを10ng/mlの濃度に含む様に再調整した.この3種類の上清を用いてSMCコロニーの進展距離を測定した.また各上清を用いて,SMCを培養し,各群の増殖能をMTT assayを用いて検討した. 実験3AGMのAIHに与える影響 12週齢・雄性New Zealand White Rabbitを用いて,1週間の通常食餌の後,術前2週間1%コレステロール含有食餌にて飼育した.ウサギの右頚動脈を内径2mm,2cm長のePTFEグラフトを用いて置換した.吻合は,両側端々吻合にて行った.吻合終了後,以下の4群を作成した.対照群:吻合後追加処置なし(n=16),AGM(-)群:両側吻合部に各々0.25mlずつ白色ワセリンを塗布(n=17),AGM(0.5)群:両側吻合部にAGMを0.1mg/ml含有するように調整した白色ワセリンを0.25mlずつ塗布(n=18),AGM(5)群:両側吻合部にAGM-1470を1.0mg/ml含有するように調整した白色ワセリンを0.25mlずつ塗布.(n=16) 術後コレステロール含有食餌にて8週間飼育した後,置換したグラフトを摘出した.摘出標本は,矢状断で切開し,ホルマリン固定した.固定後,各標本を長軸方向に4分割し,HE染色と抗ミオシン重鎖抗体による免疫組織染色を行った,また吻合部近傍の内膜肥厚部の厚さを測定し,最も厚い部位の厚さを各標本の内膜厚とした.標本の長軸方向の4分割する際,垂直方向に切離されていないため,グラフト厚を同時に測定し,内膜厚/グラフト厚(I/Gratio)を計測し,内膜肥厚の指標とした. 結果 実験1-1 ずり応力を負荷されることによりSMCの遊走能は抑制され,高ずり応力群と静止状態群の間に有意差を認めた.増殖能は高ずり応力群で最も亢進しており,ずり応力負荷によりSMCの増殖能は亢進され,各群間に有意差を認めた. 実験1-2 遊走能において,SMC(static)EC(shear)群とSMC(static)EC(static)群間,SMC(static)EC(shear)群とSMC(shear)EC(shear)群間に有意差を認めた.増殖能は群間に有意差を認めなかった. 実験2-1 遊走能は,抗PDGF-B抗体により抑制され,Anti-PDGF(+)群Anti-PDGF(-)群間と,Anti-PDGF(-)群静止上清群間に有意差を認めた.増殖能は各群間に有意差を認めなかった. 実験2-2 遊走能は,AGMにより抑制され,AGM(0)群AGM(1.0)群間,AGM(0)群AGM(10)群間,AGM(0.1)群AGM(1.0)群間,AGM(0.1)群AGM(10)群間にそれぞれ有意差を認めた.増殖能は各群間に有意差を認めなかった. 実験2-3 SMCの遊走能は,AGMがECに作用しなかった群(Sheared-EC(AGM+)群)よりもECに作用した群(Sheared-EC(AGM+)群)で有意に抑制された.この両群は,Non-sheared-EC群に比して有意に遊走能が抑制された.増殖能は各群間に有意差を認めなかった. 実験3 術後8週犠死時のグラフト開存率は,対照群44%,AGM(-)群47%,AGM(0.5)群39%,AGM(5)群38%であり,各群間に有意差を認めなかった,全例においてグラフト全長において仮性内膜の形成を認め,吻合部近傍においては宿主動脈側にも進展するAIHを認めた.AGMは,中枢側・末梢側吻合部いずれにおいてもAIHを容量依存性に抑制した.中枢側では対照群AGM(5)群間,AGM(-)群AGM(5)群間,AGM(-)群AGM(0.5)群間に有意差を認め,末梢倒では対照群AGM(5)群間,対照群AGM(0.5)群間,AGM(-)群AGM(5)群間にそれぞれ有意差を認めた.宿主動脈内のSMCに連続して,抗ミオシン重鎖抗体陽性細胞が吻合部を越えて仮性内膜内へ進展していた.陽性細胞は吻合部内膜内において多く認められ,吻合部からの距離が離れるにしたがって陽性細胞数が少なくなっていた. 考察 両方向性のずり応力下においては,SMCの遊走能は抑制され,増殖能は亢進された.定常流によるずり応力は,SMCのDNA合成能を抑制すると報告されている.一方で,ずり応力下でSMCがPDGFを産生するとの報告もみられる.今回の結果は,前者の増殖能抑制には矛盾するが,後者の報告とは矛盾しない.その違いは,今後の検討課題であるが,現時点ではずり応力の違いに原因があると考えざるをえない. ずり応力下でECが産生する増殖因子の存在下においても,SMCの遊走能はずり応力により抑制された.血管吻合部では,ECの傷害・欠損が起こり,仮性内膜に被われる.今回の検討によると,傷害されたECや血小板により産生される増殖因子によりSMCは,中膜から内腔面へ遊走し,内腔面に達して直接血流にさらされると,その場で増殖することになり,再狭窄の原因となると考えられる.その後仮性内腹に被覆されることにより増殖能の亢進は停止することとなる.今回の結果は実際の臨床結果に一致する. 血管新生は,AIHに関与していると報告されている.ECは,ずり応力下で増殖因子を産生することによりSMCの遊走・増殖に関与してするばかりではなく,血管新生を介してAIHに関与していると考えられる.血管新生抑制剤AGMを使用して,ECを介したSMCの遊走・増殖について検討を行った.AGMは,10ng/mlでSMCの遊走能を抑制したが,増殖能については影響を与えなかった.同剤は高濃度でcytotoxicに作用し,低濃度でcytostaticに作用することにより腫瘍の増殖を抑制すると報告されており,今回の結果は諸家の報告に矛盾しない.さらに今回の検討では、AGMがECのずり応力下におけるPDGF産生を抑制したと考えられた.AGMは,吻合部周囲の血管新生を抑制し,ECのPDGF産生能を抑制し,さらにSMCの遊走・増殖能をも抑制することによりAIHを抑制できる可能性が示された. AGMは,高脂血症ウサギ頚動脈ePTFEグラフト置換モデルにおいて,局所投与により重大な副作用を認めずにAIHを抑制した.抗SM1抗体を用いた免疫組織学的検討において,薬剤投与群において吻合部からグラフト中央への抗SM1抗体陽性細胞の進展減少が認められた.AGMは,SMCの遊走・増殖能の抑制能を持つことが確認されており,in-vivoのAIH抑制にはこの抑制作用が効果していると考えられた. まとめ 両方向性のずり応力は,SMCにの遊走能を抑制するとともに,増殖能を亢進した.また,両方向性のずり応力は,ECにSMCの遊走・増殖能に影響を与えるPDGFを産生させた.ECは,ずり応力下におけるPDGF産生能のみならず,血管新生機序介してAIH内のSMCに影響を与えるが,AGMはこの2経路をどちらも抑制することが確認された.さらにAGMは,局所投与により人工血管置換後のAIHを抑制した.今後,新しいdrug delivery systemの開発が進めば,さらに薬剤の投与プログラミングを調整することが可能となり,AGM局所投与は,AIH抑制の良い治療戦略になりうることが明らかになった. |
| 審査要旨 | | 小口径人工血管の主たる閉塞原因は,吻合部内膜肥厚である.その本態は血管平滑筋細胞の過剰な遊走・増殖であるが,未解明の点も多い.小口径人工血管を用いる際には,端側吻合を行なうことが多く,末梢側吻合部の血流は解剖学的な理由からto-and-froの両方向性の乱流になる.また肥厚仮性内膜内には新生血管が認められる.以上から新生血管と吻合部における乱流によるずり応力という2種類の血流の関与が,いかに吻合部内膜肥厚に影響を与えているかを検討することは,吻合部内膜施行を抑制する上で非常に有用である.本研究は,まずin-vitroにおいて両方向性のずり応力の血管平滑筋細胞の遊走・増殖能に与える影響と両方向性のずり応力かの血管内皮細胞を介した平滑筋細胞の遊走・増殖能に与える影響について解明を試みた.続いてこの血管内皮細胞を介した血管平滑筋細胞の遊走・増殖能に与える影響に血管新生抑制物質AGM1470が如何に作用するか解明を試みた.最後にin-vivoにおいて,AGM1470の小口径人工血管を用いた後の吻合部内膜肥厚対する影響について解明を試みたものであり,以下の結果を得ている. 1)血管平滑筋細胞・血管内皮細胞を両方向性のずり応力下で培養し,その遊走・増殖能を測定した.両方向のずり応力は,血管平滑筋細胞の遊走能を抑制し,増殖能を亢進させた.また両方向性のずり応力下培養した血管内皮細胞の上清を用いて,血管平滑筋細胞を培養し,その遊走・増殖能を測定した結果,血管平滑筋細胞の遊走能は亢進されたが,増殖能には変化を認めなかった.両方向性のずり応力下で培養した血管内皮細胞の産生した増殖因子はPDGFであった. 2)血管平滑筋細胞をAGM-1470の存在下で培養しその遊走・増殖能を測定した.遊走能はAGM-1470の濃度に比例して抑制されたが,増殖能は影響を受けなかった.またAGM-1470存在下で培養した血管内皮細胞の上清を用いて血管平滑筋細胞の遊走能を測定した.血管平滑筋細胞の遊走能は,AGM-1470により血管内皮細胞のPDGF産生が抑制されることにより,抑制された. 3)高脂血症ウサギのePTFE人工血管頚動脈置換モデルを用いて,AGM-1470局所投与の吻合部内膜肥厚に与える効果を検討した.AGM-1470局所投与は,AGM-1470の濃度に比例して吻合部から人工血管内への血管平滑筋細胞の遊走を抑制し,吻合部内膜肥厚も抑制していた. 以上の結果から,両方向性のずり応力は,血管平滑筋細胞にの遊走能を抑制するとともに,増殖能を亢進し,血管内皮細胞にPDGFを産生させ吻合部内膜肥厚形成に関与していると考えられた.AGM-1470は,この両細胞に作用して血管平滑筋細胞の遊走・増殖を抑制すると考えられた.さらにAGM-1470は,局所投与により人工血管置換後の吻合部内膜肥厚を抑制し,AGM1-470の局所投与は吻合部内膜肥厚抑制の良い治療戦略になりうると考えられた.乱流下の血管平滑筋細胞の遊走・増殖能についての報告はほとんど認められず,さらに人工血管置換後の吻合部内膜肥厚に対して血管新生をターゲットとした研究は報告されていない.本研究は,人工血管移植後の吻合部内膜肥厚抑制の研究を進めていく上で重要な貢献をなすものと考えられ,学位の授与に値するものと考えられる. |