薬剤誘発性の不整脈は、薬物による副作用の中でも患者の生命に直結する可能性が高く、臨床上特に注意を要するものの一つといえる。催不整脈作用を有する薬物は数多いが、近年臨床においては、非循環器系薬剤によって致死性の心室性不整脈であるtorsades de pointes(トルサード・ド・ポワンツ;TdP)が生じた症例が多く報告され、特に問題となっている。このような循環系副作用の予測は臨床上困難であるが、ひとたび発生すれば致死的な心室細動へと移行して死亡する可能性も高く、非常に重篤性が高い副作用である。したがって、これらの副作用を定量的に予測することは、医薬品の適正使用の観点から重要な課題であるといえる。しかし、薬物の催不整脈作用の評価・検討をヒトにおいて行うことは安全面や倫理面から困難である。そこで本研究においては、ラットを用いて、TdPの危険性を反映するよい指標であるされているQT間隔に対する薬物の作用を定量的に評価するためのin vivo実験系を構築した。そして、当該評価系を用いて、新規非鎮静型抗アレルギー薬であるテルフェナジン、エバスチンならびにエピナスチンについて、薬物の体内動態とQT延長作用との関係を検討した。 一方、催不整脈作用に対するin vitroからのアプローチとして、心筋の再分極に関与しているカリウムチャネル電流に対する薬物の阻害作用と、催不整脈作用との間に密接な関係があることが指摘されてきた。そこで、in vitroにおける心筋カリウム電流阻害強度からin vivoにおけるQT延長作用を予測することを目的に、ラット単離心筋細胞を用いた電気生理学的検討を行った。 まず、in vivoラットを用い、薬剤誘発性QT延長の評価系の確立を目的として、QT間隔の延長やTdPを引き起こす代表的薬物であるキニジンを用いた検討を行った。S.D.系雄性ラットを麻酔下に心電図を記録し、キニジンを10及び30mg/kg/hの速度で定速静脈内投与した際の心電図の経時変化を検討した。その結果、キニジンによる投与速度依存的なQT間隔の延長が認められた(図1(A))。次に、別の個体を用いてキニジンの血漿中濃度推移を検討し、これと先のQT延長作用との関係を解析した。その結果、両者の関係は直線的であり、ヒトにおける臨床血漿中濃度、すなわち2-5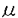 g/mLの範囲において、11-27msecのQT間隔の延長が認められた(図1(B))。これらの結果から、本評価系を用いることにより、薬物のQT延長作用を薬物動態・動力学的側面から定量的に評価できることが示された。 g/mLの範囲において、11-27msecのQT間隔の延長が認められた(図1(B))。これらの結果から、本評価系を用いることにより、薬物のQT延長作用を薬物動態・動力学的側面から定量的に評価できることが示された。  図1 ラットにキニジンを定速注入した際の(A)QT間隔の経時変化(n=3-5,mean±SEM)及び(B)血漿中濃度とQT間隔延長作用との関係 図1 ラットにキニジンを定速注入した際の(A)QT間隔の経時変化(n=3-5,mean±SEM)及び(B)血漿中濃度とQT間隔延長作用との関係 続いて本評価系を用いて、新規非鎮静型抗アレルギー薬であり臨床的にTdPの危険性が報告されているテルフェナジン、及びその代替薬候補とされているエバスチン、並びにエピナスチンについてQT間隔延長作用と血漿中薬物濃度との関係を解析した。エピナスチンについては血漿中濃度の定量法が報告されていなかったため、HPLC-UV法による定量法を開発した。本定量法により、血漿中エピナスチン濃度を精度よく測定することが可能となった。続いて、テルフェナジン(5,10及び15mg/kg/h)、エバスチン(3及び10mg/kg/h)およびエピナスチン(1及び3mg/kg/h)をラットに定速静脈内投与し、その際の血漿中濃度とQT延長作用の関係を解析した。 その結果、テルフェナジンは、臨床濃度よりは高いものの、代謝阻害剤の併用などによって到達する可能性がある濃度域(〜200ng/mL)において濃度依存的なQT間隔の延長を引き起こした(図2、表1)。テルフェナジンの血漿中濃度と効果の関係は、効果コンパートメントを仮定したEmaxモデルによって関係づけることが出来た。QT間隔を10msec延長するのに必要なテルフェナジンの濃度(EC10msec)は0.51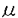 g/mLであった。エバスチンもテルフェナジン同様高濃度域において濃度依存的なQT間隔の延長を引き起こしたが、その作用はテルフェナジンよりも弱く、EC10msecは2.9 g/mLであった。エバスチンもテルフェナジン同様高濃度域において濃度依存的なQT間隔の延長を引き起こしたが、その作用はテルフェナジンよりも弱く、EC10msecは2.9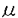 g/mLであった(表1)。一方エピナスチンは臨床血漿中濃度の20倍程度の高濃度においてもQT間隔延長作用を示さなかった(表1)。 g/mLであった(表1)。一方エピナスチンは臨床血漿中濃度の20倍程度の高濃度においてもQT間隔延長作用を示さなかった(表1)。 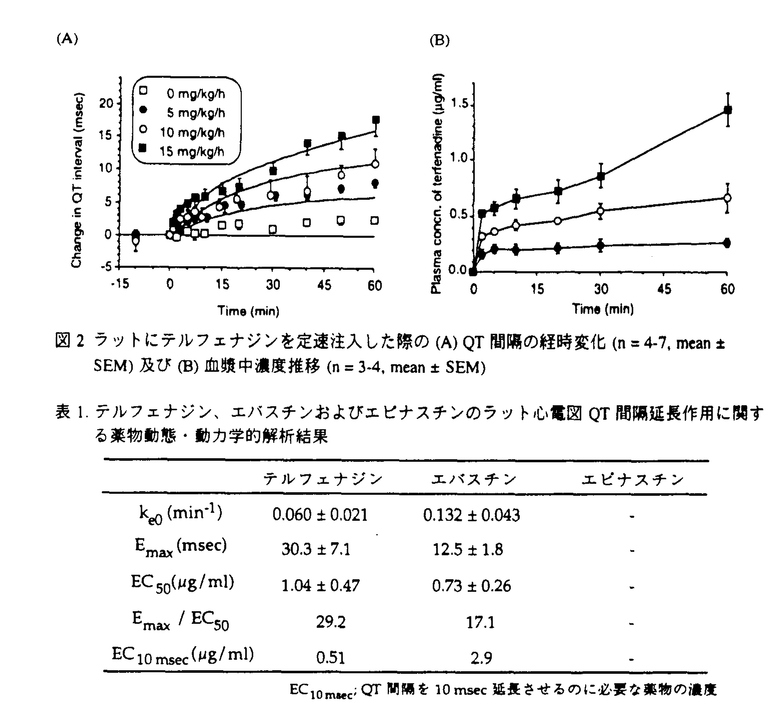 図表図2 ラットにテルフェナジンを定速注入した際の(A)QT間隔の経時変化(n=4-7,mean±SEM)及び(B)血漿中濃度推移(n=3-4,mean±SEM) / 表1.テルフェナジン、エバスチンおよびエピナスチンのラット心電図QT間隔延長作用に関する薬物動態・動力学的解析結果 図表図2 ラットにテルフェナジンを定速注入した際の(A)QT間隔の経時変化(n=4-7,mean±SEM)及び(B)血漿中濃度推移(n=3-4,mean±SEM) / 表1.テルフェナジン、エバスチンおよびエピナスチンのラット心電図QT間隔延長作用に関する薬物動態・動力学的解析結果 以上の結果と各薬物の体内動態学的特性を考慮すると、これら新規非鎮静型抗アレルギー薬の不整脈誘発危険性はテルフェナジン エバスチン>>エピナスチンの順であると考えられた。 エバスチン>>エピナスチンの順であると考えられた。 最後に、in vitroにおける心筋カリウム電流阻害強度とin vivoにおけるQT延長作用との関係を明らかにすることを目的として、3種の新規非鎮静型抗アレルギー薬(テルフェナジン、エバスチン、エピナスチン)を対象に、ラット単離心筋を用いた検討を行った。S.D.系雄性ラットを麻酔下、心臓を摘出しランケンドルフ標本とし、ここにコラゲナーゼを含む生理塩溶液を灌流することにより心筋を酵素的に消化した。心室細胞を単離し、whole cell patch clamp法により膜電流を記録した。すなわち、保持電位を-90mVとし、Co2+イオン存在下にNa電流不活性化のためのプレパルス(-20mV,15msec)に続く+20mVへの100msecの脱分極パルスを与え、外向き電流を記録した。電流成分としては遅延整流カリウム電流(IK)および一過性外向きカリウム電流(Ito)を記録した。IKの測定にあたってはItoの阻害剤である4-amino-pyridineの、Itoの測定にあたってはIKの阻害剤であるtetraethylammoniumの存在下での電流波形を記録し、IKは脱分極刺激の最終時点での電流強度を、Itoは一過性成分の時間曲線下面積をそれぞれ電流の大きさとした。そして、両電流に対する3種の薬物の阻害強度を検討した。 その結果、IKに対する阻害強度はテルフェナジン エパスチン>>エピナスチンの順となりin vivoにおけるQT延長の順位と一致した。IC50はそれぞれ5.96 エパスチン>>エピナスチンの順となりin vivoにおけるQT延長の順位と一致した。IC50はそれぞれ5.96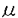 M,15.3 M,15.3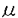 Mおよび145 Mおよび145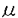 Mであった(図3)。一方、Itoについては、いずれの薬物もIKに対するより弱いか、もしくは同程度の阻害能しか示さず、さらにその強度の順位もin vivoにおける結果とは一致しなかった。以上、in vitroラット単離心筋を用いた電気生理学的検討も、薬剤のin vivoにおける催不整脈作用を比較・検討する際の有用な方法論となり得ることが示された。 Mであった(図3)。一方、Itoについては、いずれの薬物もIKに対するより弱いか、もしくは同程度の阻害能しか示さず、さらにその強度の順位もin vivoにおける結果とは一致しなかった。以上、in vitroラット単離心筋を用いた電気生理学的検討も、薬剤のin vivoにおける催不整脈作用を比較・検討する際の有用な方法論となり得ることが示された。  図3 ラット心室筋IK電流に対する(A)テルフェナジン、(B)エバスチン及び(C)エピナスチンの阻害作用(カッコ内は例数、mean±SEM) 図3 ラット心室筋IK電流に対する(A)テルフェナジン、(B)エバスチン及び(C)エピナスチンの阻害作用(カッコ内は例数、mean±SEM) 結果として、現在臨床において問題となっている薬物の催不整脈作用(QT延長作用)を、ラットを用いて簡便に予測、評価するための方法論を確立することができた。そして、今回構築した評価系を用いて代表的な3種の非鎮静型抗アレルギー剤についてその不整脈誘発能を比較したところ、それらの不整脈誘発危険性はテルフエナジン エバスチン>>エピナスチンの順であることが示され、臨床的に有用な医薬品情報を構築することができた。さらに、in vitroにおける心筋カリウム電流に対する薬物の阻害能を検討した結果、それらとin vivoにおけるQT間隔の延長強度の間には相関が認められ、in vitroラット単離心筋を用いた実験系は、in vivoにおける薬剤の催不整脈作用を比較する際の有用な方法論となり得ることが示された。 エバスチン>>エピナスチンの順であることが示され、臨床的に有用な医薬品情報を構築することができた。さらに、in vitroにおける心筋カリウム電流に対する薬物の阻害能を検討した結果、それらとin vivoにおけるQT間隔の延長強度の間には相関が認められ、in vitroラット単離心筋を用いた実験系は、in vivoにおける薬剤の催不整脈作用を比較する際の有用な方法論となり得ることが示された。 |