| 1.生体における有機アニオン輸送の意義 生体内では代謝により種々有機アニオンが産生されている。薬物や環境物質、食品添加物などの外来性物質にも多くの有機アニオンが含まれ、さらにその代謝産物(主に抱合体)もその多くが有機アニオンに属する。腎臓および肝臓はこれら有機アニオンの排泄および代謝に重要な役割を果たしている。近位尿細管細胞および肝細胞は有機アニオンの経細胞輸送を行っており、血液中から取り込んだ有機アニオンをそれぞれ尿中、胆汁中に排泄している。これまで腎および肝での有機アニオン経細胞輸送は生理学的および薬理学的に精力的な研究が行われてきた。特に尿細管の有機アニオン輸送の研究は50年以上の歴史を持ち、PAH(パラアミノ馬尿酸)輸送系として広く知られている。 PAH輸送系は、腎生理学においては尿細管分泌における最も重要な輸送系の一つとして位置づけられている。また、PAH輸送系は基質選択性が極めて広い輸送系(multispecific organic anion transporter)としても知られ、有機アニオンに属する多くの内因性物質や薬物およびその代謝物をその輸送基質としている。このため薬物動態学の分野ではPAH輸送系は薬物トランスポーターとしても知られている。さらに腎毒性発現物質の多くがPAH輸送系の基質となることが推定され、腎毒性発現機序の研究においても注目されている。 このように腎有機アニオン輸送系(PAH輸送系)は多方面の研究者により関心が持たれ、その分子クローニングも複数の研究者により試みられていたが、その分子的実体は不明のままであった。近年、近位尿細管の基底側膜に存在するPAHトランスポーターはPAH/dicarboxylate exchangerであるというモデルが提唱された。私は、このPAHトランスポーターを同定するにはPAH輸送の対向基質であるdicarboxylateが細胞内に十分に存在することが必須であると推論し、以下の方法によりPAHトランスポーターを単離した。さらに、PAHトランスポーターとの構造上の類似性からこれまで機能が不明であった肝臓特異的な膜タンパクが有機アニオントランスポーターであることを明らかにした。 2.rat Na+-dicarboxylate co-transporter(rNaDC-1)の単離とその解析 1995年にラビット腎のcDNA libraryからNa+-dicarboxylate co-transporter(NaDC-1)が単離された。細胞内にdicarboxylateを取り込ませるための輸送系として用いるためにrat NaDC-1(rNaDC-1)を単離し、あわせてその解析を行った。NaDC-1のDNA配列を基にしたラット腎cDNA libraryのhomology screeningの結果、2245bpよりなるrNaDC-1を単離した。rNaDC-1はNaDC-1とアミノ酸レベルで73%のidentityを有しており、アフリカツメガエル卵母細胞に発現させると、細胞外Na+に依存したdicarboxylate(succinate,glutarate,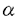 -ketoglutarate)およびtricarboxylate(citrate)の取り込みが観察された。rNaDC-1による基質輸送は起電性であり、基質輸送に伴い内向き電流が観察された。citrateについては、その輸送量と輸送に伴う電荷の移動量を同時に測定し、citrateの持つ3つのカルボキシル基のうちの1つがプロトン化された状態で輸送されることを示した。さらに、rNaDC-1のC-末端の14アミノ酸に対して作製した特異抗体によって、rNaDC-1が近位尿細管のS2およびS3の管腔側にのみ発現していることを明らかにした。 -ketoglutarate)およびtricarboxylate(citrate)の取り込みが観察された。rNaDC-1による基質輸送は起電性であり、基質輸送に伴い内向き電流が観察された。citrateについては、その輸送量と輸送に伴う電荷の移動量を同時に測定し、citrateの持つ3つのカルボキシル基のうちの1つがプロトン化された状態で輸送されることを示した。さらに、rNaDC-1のC-末端の14アミノ酸に対して作製した特異抗体によって、rNaDC-1が近位尿細管のS2およびS3の管腔側にのみ発現していることを明らかにした。 3.multispecific organic anion transporter(OAT1)の発現クローニングによる単離とその解析 ラット腎より調製したpoly(A)+RNAのみを卵母細胞に発現させてもPAHの取り込み活性は検出されなかったが、ラット腎poly(A)+RNAおよびrNaDC-1 cRNAを卵母細胞に共発現させ、さらにglutarateで前処置した後にPAHの取り込みを観察したところ、有意なPAHの取り込みが観察された。さらにこの輸送は、PAH輸送系の特異的なinhibitorであるprobenecidで完全に抑制された。次いで、ラット腎poly(A)+RNAを約400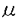 g調製してpreparative agarose gel electrophoresis法により80の画分にサイズ分画し、前記の共発現系を用いて最も高いPAH取り込み活性を示す画分を決定した。この結果、約1.5-2.5kbのサイズのpoly(A)+RNA画分が最も高いPAH取り込み活性を示し、この画分よりunidirectionalなcDNA libraryを作製した。このcDNA libaryより約8000個のクローンをスクリーニングすることにより、高いPAH取り込み活性を示すクローン(OAT1)を単離した。 g調製してpreparative agarose gel electrophoresis法により80の画分にサイズ分画し、前記の共発現系を用いて最も高いPAH取り込み活性を示す画分を決定した。この結果、約1.5-2.5kbのサイズのpoly(A)+RNA画分が最も高いPAH取り込み活性を示し、この画分よりunidirectionalなcDNA libraryを作製した。このcDNA libaryより約8000個のクローンをスクリーニングすることにより、高いPAH取り込み活性を示すクローン(OAT1)を単離した。 OAT1は551アミノ酸よりなる膜蛋白質で12個の膜貫通部位を持つことが予想された。意外なことに、OAT1は有機カチオントランスポーター(OCT1)とアミノ酸レベルで弱い相同性(38%)を有していた。OAT1のmRNAの発現は腎特異的であり、腎以外の組織では脳に弱い発現を見るのみであった。腎のin situハイブリダイゼーションからOAT1は近位尿細管の中間部(S2)に最も高い発現をしていることが予想された。卵母細胞に発現させたOAT1はPAHを高親和性に輸送し(Km=14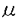 M)、その輸送はNa+非依存性であった。このPAHの輸送は細胞内のジカルボン酸濃度に依存した。この事実はOAT1が交換輸送体であることを示唆する。 M)、その輸送はNa+非依存性であった。このPAHの輸送は細胞内のジカルボン酸濃度に依存した。この事実はOAT1が交換輸送体であることを示唆する。 OAT1の輸送基質を検討するために、各種薬物および内因性物質の14C-PAH取り込みに対する阻害実験、および放射能標識された基質を用いた取り込み実験を行った。PAHの卵母細胞への取り込みは、構造の異なる様々な薬物(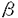 ラクタム系抗生物質、利尿薬、非ステロイド性抗炎症薬、尿酸排泄薬、methotrexate)やprostaglandin E2、cAMP、cGMP.urate、 ラクタム系抗生物質、利尿薬、非ステロイド性抗炎症薬、尿酸排泄薬、methotrexate)やprostaglandin E2、cAMP、cGMP.urate、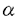 -ketoglutarate等の内因性物質により抑制された。放射能標識された基質を用いて取り込み実験を行ったところ、methotrexate、cAMP、cGMP、prostaglandin E2、urate、 -ketoglutarate等の内因性物質により抑制された。放射能標識された基質を用いて取り込み実験を行ったところ、methotrexate、cAMP、cGMP、prostaglandin E2、urate、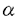 -ketoglutarateのがOAT1により実際に細胞内に輸送されることを確認した。 -ketoglutarateのがOAT1により実際に細胞内に輸送されることを確認した。 OAT1が示す組織分布、輸送形式ならびに基質特異性は、生理学的、薬理学的に検討されてきた近位尿細管の有機アニオン輸送系のそれと完全に一致する。 4.liver specific organic anion transporterの同定とその解析 OAT1のsequenceを基にしてDNA data baseの検索を行ったところ、肝特異的な発現を示す膜タンパク(NLT:novel liver transporter)がOAT1とアミノ酸レベルで42%のhomologyを有することが明らかになった。NLTはglucagon受容体に対して作製された抗体を用いて単離された12回膜貫通型の膜タンパクで、肝臓の基底側膜に限局した発現を示すことが1994年に報告されていた。その構造上の特性からNLTはトランスポーターであろうと推論されていたが、その輸送基質は未知であった。私は、OAT1との構造の類似性およびその特異的な組織局在から、NLTが肝の有機アニオントランスポーターであろうと推論し、NLTの単離およびその解析をおこなった。 NLTをラット肝cDNA libraryより単離し、卵母細胞に発現させたところ、salicylate、 acetylsalicylate、dicarboxylates、methotrexate、prostaglandin E2、PAH等の輸送を確認した。salicylateおよび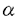 -ketoglutarateのNLTによる輸送のKm値はそれぞれ89および18 -ketoglutarateのNLTによる輸送のKm値はそれぞれ89および18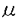 Mであった。この結果上りNLTとして報告されていた膜タンパクをorganic anion transporter 2(OAT2)と再命名した。OAT2による有機アニオン輸送はOAT1と同様に細胞外Na+に非依存的であった。OAT2の組織発現をNorthern blotにより検討したところ、肝臓に強い発現がみられる他は腎臓に弱い発現が見られるのみで、脳、目、小腸、大腸、精巣、胎盤、肺、膵臓には全くその発現は認められなかった。以上の結果からOAT2は肝特異的な有機アニオントランスポーターであることが結論された。 Mであった。この結果上りNLTとして報告されていた膜タンパクをorganic anion transporter 2(OAT2)と再命名した。OAT2による有機アニオン輸送はOAT1と同様に細胞外Na+に非依存的であった。OAT2の組織発現をNorthern blotにより検討したところ、肝臓に強い発現がみられる他は腎臓に弱い発現が見られるのみで、脳、目、小腸、大腸、精巣、胎盤、肺、膵臓には全くその発現は認められなかった。以上の結果からOAT2は肝特異的な有機アニオントランスポーターであることが結論された。 5.結論 腎特異的multispecific organic anion transorter(OAT1)の発現クローニングおよびその解析、さらにOAT1のisoformであるOAT2の機能の特定をおこなった。又、OAT1のクローニングに際して必要であったrNaDC-1については、これまで示されていなかった輸送の起電性、citrateの輸送特性およびrNaDC-1の腎内および細胞内局在を明らかにした。 OAT1は腎における有機アニオン排泄において中心的な役割を果たしているトランスポーターと考えられた。OAT1の構造に関する情報から、肝特異的OAT2の存在を明らかにすることができた。このファミリーのメンバーは今後さらに増加するものと考えられ、生体内での有機アニオンの組織への分布および排泄の機構の解明に重要な貢献が期待される。 OAT1およびOAT2の示す多選択性は興味深い問題で、私は今後分子生物学的な手法を用いて、そのbinding siteの同定およびその特性を明らかにする研究へと発展させる所存である。 |