学位論文要旨
| No | 214354 | |
| 著者(漢字) | 樋坂,章博 | |
| 著者(英字) | ||
| 著者(カナ) | ヒサカ,アキヒロ | |
| 標題(和) | Nonlinear Dispersion Modelを用いた肝局所動態および全身動態の解析 : ペプチド性エンドセリン拮抗剤BQ-123の肝細胞内への輸送 | |
| 標題(洋) | ||
| 報告番号 | 214354 | |
| 報告番号 | 乙14354 | |
| 学位授与日 | 1999.06.09 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第14354号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | In vitroおよびin vivoの薬物動態、特に臓器内局所薬物動態を解析する従来の手法は、その多くが線形を仮定するものであった。本研究ではこれを拡張し、特にdispersion model(拡散モデル)の数値解法を確立して、非線型かつ非平衡の動態の精緻な解析および予測を可能にすることを目的とした。また、この方法の有用性を確かめるために、新規エンドセリンレセプター拮抗剤で環状ペンタペプチド構造を持つBQ-123のラット遊離肝細胞への取込みを遠心ろ過法で、また肝排泄をmultiple indicator dilution(MID)法による臓器灌流実験で検討し、その肝臓局所および全身動態にnonlinear dispersion modelを適応して統合的に解析した。 ラットにBQ-123を静脈内投与後の血漿中濃度の減少は極めて速やかで、また胆汁中に回収される未変化体は投与量の87%に達した。胆汁中および尿中に排泄される未変化体の合計はほぼ100%であり、本化合物は代謝を受けないと考えられた。従ってBQ-123が血漿中から速やかに消失するのは、活発な胆汁排泄を受けるためであることが明らかであった。BQ-123の投与量を1から25mg/kgへと上昇させると肝クリアランスが約半分に低下したことから、BQ-123の胆汁中への移行には飽和性がある、すなわち非線形のプロセスであることが分かった。 BQ-123のラット遊離肝細胞への取込みをシリコンオイル急速遠心濾過法により解析した。3H-BQ-123は肝細胞に時間および温度依存的に取込まれ、また高濃度では取込みの飽和が顕著であった。取込みには部分的なNa+依存性が認められ、Na+依存的および非依存的取込みのKmはそれぞれ6及び12 3H-BQ-123の肝細胞への取込みは代謝拮抗剤、類縁のペプチド、胆汁酸および有機アニオン類により阻害された。特に類縁のペプチドについては、BQ-123と同様に負電荷を持っBQ-485の阻害が強く、正電荷を持つBQ-587による阻害は弱かった。 以上より、BQ-123は血液中から肝細胞にエネルギー依存的な担体輸送により活発に取込まれることが示された。またこの担体の化合物の認識には、ペプチド性の構造よりもむしろ電荷が重要と考えられた。なお、本研究の後、申、Akhteruzzamanらは胆管側膜ベシクルを用いた検討により、BQ-123は肝細胞から胆汁中へもcMOATの関与により能動的に輸送されていることを報告している。 遊離肝細胞で認められたBQ-123の取込みの輸送能は、実際の肝臓の臓器クリアランスあるいはin vivoの全身クリアランスに充分見合うものであろうか。本研究はこの問に対し非線形性をも含めて充分な答えを与えることを目的としたものである。臓器クリアランスを検討する臓器灌流実験、特に精緻なmultiple indicator dilution(MID)法による解析には、用いる数学モデルが複雑なため非線形動態の解析が困難という欠点がある。そこで本研究では、比較的頻用されるdispersion model(拡散モデル)に新たに数値計算法を適応し、非線形動態の解析を可能にしようと考えた。 Dispersion modelは偏微分方程式で記述され、今回、この数値計算法として陽的スキームによる差分法を用いた。差分法は空間を細かな領域に分割し、適当な時間刻みごとに計算を繰り返すものである。なお、dispersion modelの偏微分方程式を解くための境界条件としてはmixedとclosedの2種類が広く認められている。しかし検証の結果、mixed条件には理論的問題が見出されたため、本研究ではclosed条件を採用した。こうして実現した計算法により、臓器の入口に瞬時注入された薬物が,時間の経過とともに拡散と流れにより出口へと到達する様子が再現された(図1)。また、その計算の精度を様々な角度から検証し、通常の範囲では誤差が1%を超えない条件を見出してこれを以降の解析に用いた。  非線型のモデルとして、最初に最も単純な1-コンパートメントモデルでMichaelis-Menten型の消失を仮定した場合についてシミュレーションを行った。投与薬剤の溶出液中への回収率は投与量により大きく変化し、非線形性が確認された。また、非消失性の対照化合物の溶出曲線との比をプロットするratio plot解析では、消失の非線型性のためにプロットの湾曲が確認された。以上の解析をさらに拡張し、持続注入時やモデルを複雑な2-コンパートメントモデルとした場合にも良好なシミュレーションが可能であった。なお本研究ではコンピュータ解析のために、差分法および非線形最小二乗法によるパラメータ最適化ルーチンを含む汎用的な薬物速度論解析プログラムNapp(Numeric Analysis Program for Pharmacokinetics)を新たに開発し、これを用いた。 3H-BQ-123のラット肝臓灌流実験をMID法に従って実施した。MID法とは被験物質と非消失性対象物質を混合して動脈側血管に瞬時注入し、静脈側より溶出するこれらの物質の濃度-時間曲線から臓器への被験物質の取込みおよび2次的漏出を精密に解析する方法である。BQ-123の投与量は、1-1000 3H-BQ-123の溶出曲線には投与量増加に伴い顕著な非線型性が認められた。溶出曲線を複数のnonlinear dispersion modelで解析した結果、非線型のクリアランスが血液のコンパートメントから直接おきると仮定する2-コンパートメントモデルが最も良くデータを説明した(図2)。このモデルにデータが適合したことは、BQ-123の肝クリアランスの非線型性の原因が肝細胞への取り込みのステップにあることを示すものである。  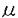 g(■)、10 g(■)、10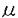 g(□)、100 g(□)、100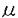 g(●)および1000 g(●)および1000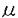 g(○)のn=3の平均値。曲線は非線形最小二乗法による解析結果を示す。 g(○)のn=3の平均値。曲線は非線形最小二乗法による解析結果を示す。 以上のMID実験で得られたパラメータに適当な換算を施し、遊離肝細胞の実験で得られたパラメータと比較を行った。なお、遊離肝細胞のパラメータはNa+依存性と非依存性の取り込みを合計して求めた。その結果、Kmは遊離肝細胞が9.5 次に灌流実験で得られたパラメータが、実際にin vivoの血漿中濃度を説明するか検証を試みた。解析には通常の2-コンパートメントモデルに肝臓の拡散モデルを組み込んだハイブリッド生理学的モデルを用いた。このモデルに灌流実験で得られたパラメータと実際に測定したラットの血漿中濃度を入力し、肝血流量QH、血液容積VB、およびperipheral compartmentとの間の平衡の速度定数を未知パラメータとして、当てはめ計算を行った結果、モデルは血漿中濃度を良く説明し、また、QHは一般に60 ml/min/kg、VBは体重の7-8%程度と言われている値とそれぞれ極めて近い解となった。従って、今回の灌流で得られたパラメータはin vivoの全身クリアランスの非線形性をも良く説明していると考えられる。 1.環状酸性ペプチドBQ-123は、ラット肝細胞に能動輸送により取り込まれ、この取り込みがin vivoの肝クリアランスを支配する最も重要な要因であることが明らかとなった。 2.差分法による拡散モデルの数値計算法を確立し、非平衡、非線形の動態の解析を可能とした。これによりMID実験による非線形動態の解析が実用的となり、また生理学的モデルへの拡散モデルの組み込みが可能となった。 以上の結果は、新医薬品の創製にあたり、その体内動態を改善をめざすにあたって有用な情報であるとともに、一般に肝クリアランスの解析、特に非線形性について、in vitroとin vivoの情報を結びつけるための新たな方法論を提案するものと考える。 | |
| 審査要旨 | In vitroおよびin vivoの薬物動態、特に臓器における局所薬物動態を解析する従来の手法は、多くが線形を仮定するものであった。本研究ではこれを拡張し、dispersion model(拡散モデル)の数値解法を確立して、非線型かつ非平衡の動態の精緻な解析を可能にした。また、その応用として、ペプチド構造を持つ新規エンドセリンレセプター拮抗剤BQ-123のラット遊離肝細胞への取込みの検討、およびmultiple indicator dilution(MID)法による臓器灌流実験を行い、結果を拡散モデルにより統合的に解析した。 BQ-123をラットに静脈内投与後、代謝は認められないにも関わらず血漿中濃度の減少は極めて速やかで、胆汁中に投与量の87%が未変化体として回収された。BQ-123の投与量を1から25mg/kgへと上昇させると肝クリアランスが約半分に低下した。従ってBQ-123が血漿中から速やかに消失するのは、活発ではあるが飽和性の胆汁排泄を受けるためであることが明らかとなった。 3H-BQ-123のラット遊離肝細胞への取込みをシリコンオイル急速遠心濾過法により解析した。3H-BQ-123は肝細胞に時間および温度依存的に取込まれた。また高濃度では取込みの飽和が認められ、Na+依存的および非依存的取込みのKmはそれぞれ6及び12 以上より、BQ-123は血液中から肝細胞にエネルギー依存的な担体輸送により活発に取込まれることが示された。またこの担体の化合物の認識には、ペプチド性の構造よりもむしろ電荷が重要と考えられた。 Dispersion modelは偏微分方程式で記述され、今回、この数値計算法として陽的スキームによる差分法を用いた。この偏微分方程式を解くための境界条件としてはmixedとclosedの2種類が一般に認められている。しかし検証の結果、mixed条件には理論的な問題点が見出されたため、本研究ではclosed条件を採用した。こうして実現した計算法の精度を様々な角度から検証し、通常の範囲では誤差が1%を超えない条件を見出した。 本研究ではこの差分法および非線形最小二乗法によるパラメータ最適化ルーチンを含む汎用的な薬物速度論解析プログラムNapp(Numeric Analysis Program for Pharmacokinetics)の開発を行った。このプログラムにより、取り込みや代謝など種々のステップに非線形性を仮定した臓器モデルの動態のシミュレーションが可能であった。 3H-BQ-123のラット肝臓灌流実験をMID法に従って実施した。MID法とは被験物質と非消失性対象物質を混合して動脈側血管に瞬時注入し、静脈側より溶出するこれらの物質の濃度-時間曲線から臓器への被験物質の取込みおよび2次的漏出を精密に解析する方法である。3H-BQ-123の投与量を1から1000 以上のMID実験で得られたパラメータに適当な換算を施し、遊離肝細胞の実験で得られたパラメータと比較を行った。なお、遊離肝細胞のパラメータはNa+依存性と非依存性の取り込みを合計して求めた。その結果、Kmは遊離肝細胞が9.5 次に通常の2-コンパートメントモデルに肝臓の拡散モデルを組み込んだハイブリッド生理学的モデルを用い、灌流実験で得られたパラメータが、実際にin vivoの血漿中濃度を説明するか検証を試みた。灌流実験で得られたパラメータと実際に測定したラットの血漿中濃度を入力し、肝血流量QH、血液容積VB、およびperipheral compartmentとの間の平衡の速度定数を未知パラメータとして、当てはめ計算を行った結果、モデルは血漿中濃度を良く説明した。従って、今回の灌流で得られたパラメータはin vivoの全身クリアランスの非線形性をも良く説明していると考えられる。 本研究によって環状酸性ペプチドBQ-123は、ラット肝細胞に能動輸送により取り込まれ、この取り込みがin vivoの肝クリアランスを支配する最も重要な要因であることが明らかとなった。また、差分法による拡散モデルの数値計算法を確立し、非平衡、非線形の動態の解析を可能とした。これは一般に肝クリアランスの解析、特に非線形性について、in vitroとin vivoの情報を結びつけるための新たな方法論を提案するものと考えられる。 以上の結果から、本研究は博士(薬学)の学位を授与するに値するものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54135 |