アミノ化合物とカルボニル化合物が反応すると褐色色素が形成される。非酵素的褐変反応として知られるこの種の反応は、食品の貯蔵、加工、調理の過程で進行する典型的な成分間反応であり、香味や物性の変化に深く関わっている。カルボニル化合物として還元糖が関与する褐変反応をとくにメイラード反応と呼び、これには酸化的に進行するものと非酸化的に進行するものとがある。後者の場合、その途上で生成する重要な中間体の1つに3-デオキシグルコソン(3-DG)がある。これは、ジカルボニル化合物の一種で、タンパク質と反応して蛍光物質や重合物質を生成する。とりわけ、これらの生成物質は、近年糖尿病関連合併症としての腎疾患、動脈硬化、神経障害、さらには老化などとの関連で注目を集め、生体内で起こるメイラード反応に医学分野からも大きな関心が寄せられるようになった。事実、3-DGは体内でも形成され、しかも、生体タンパク質との反応性に富むことが示唆されるに及び、そのタンパク質修飾の機構すなわちグリケーションの機序の基礎的解明が強く要望されていた。 本論文は、グリケーションによるタンパク質修飾が主にそのアルギニン残基の修飾であることを見いだし、3-DGとN-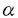 -ベンゾイル-L-アルギニンアミド(Bz-Arg・NH2)の反応系をモデルとしてこの修飾反応の機構を解析した研究をまとめたもので、序論に続く2章と結論とから成る。 -ベンゾイル-L-アルギニンアミド(Bz-Arg・NH2)の反応系をモデルとしてこの修飾反応の機構を解析した研究をまとめたもので、序論に続く2章と結論とから成る。 第1章は、3-DGによるタンパク質修飾の程度を解析した結果を述べている。すなわち、リゾチーム、リボヌクレアーゼA、免疫グロブリンを試料として選び、それぞれにグルコースおよび3-DGを反応させてアミノ酸残基の損傷率、タンパク質重合度を調べたところ、グルコースよりも3-DGの方がこれらの変化に大きく寄与していた。この場合、損傷を受けたアミノ酸残基のうちの主要なものはアルギニン残基であり、損傷の様式は3-DGの付加であって、しかもそれがタンパク質分子中に結合型として残留していた。 第2章は、タンパク質中のアルギニン残基のこうした修飾変化の機構を解析した結果を述べている。すなわち、解析を簡明にするために3-DG-Bz-Arg・NH2モデル系を設定し、生体環境を模した条件で反応させたところ、実際系(第1章)におけるのと同様な反応生成物が検出されたことから、このモデル系の使用が妥当であると判定された。そこで、主要な反応生成物をHPLCによって単離し、高分解能FAB(+)-MS,NMRなどによる構造解析を行った。その結果、3-DGとBz-Arg・NH2の1:1反応生成物の主要なものとして2-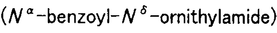 -5-(2,3,4-trihydroxybutyl)-2-imidazoline-4-one(I),2- -5-(2,3,4-trihydroxybutyl)-2-imidazoline-4-one(I),2-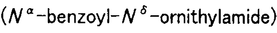 -5-(2,3,4-trihydroxybutyl)-4-imidazolone(II)の2種類、2:1反応生成物として2- -5-(2,3,4-trihydroxybutyl)-4-imidazolone(II)の2種類、2:1反応生成物として2-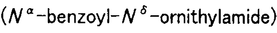 -5,6a-di(2,3,4-trihydroxybutyl)-5,6-dihydroxydehydrofuro[2,3-d]imidazole(III)の構造が決定された。そこで、各反応生成物の経時的増減を測定し下記の反応機構を推定した。 -5,6a-di(2,3,4-trihydroxybutyl)-5,6-dihydroxydehydrofuro[2,3-d]imidazole(III)の構造が決定された。そこで、各反応生成物の経時的増減を測定し下記の反応機構を推定した。 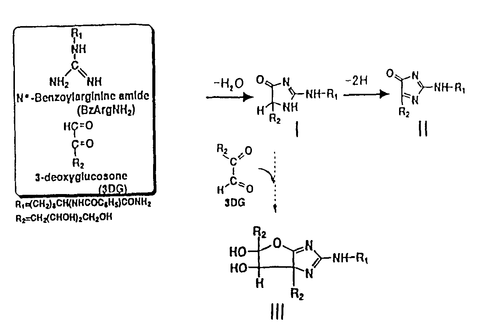 これによれば、3-DGのカルボニル炭素にグアニジル窒素が求核付加した後に縮合してIが生成し、さらにこれが酸化されてIIになる反応が主経路である。また、Iに3-DGがさらに反応してIIIが生成する機構もありうる。最近、他の研究グループが上記の研究に基づいてIおよびIIの特異モノクローナル抗体を作製し、これらが糖尿病誘発ラットおよび患者の腎組織、赤血球、アミロイド沈着組織に存在することを確認している。 以上を要するに、本研究は、メイラード反応の過程でイミダゾロン骨格を有する新たな化合物が生成し、しかもそれが糖尿病合併症の患者の組織に実在してこれらの疾病に深く関与する可能性のあること、さらには病態のマーカーとして利用しうることを初めて示したものであり、学術面でも応用面でも寄与するところが大きいと期待している。 |