学位論文要旨
| No | 214373 | |
| 著者(漢字) | 森兼,啓太 | |
| 著者(英字) | ||
| 著者(カナ) | モリカネ,ケイタ | |
| 標題(和) | 膵癌細胞同所注入モデルによる膵内の臓器特異的免疫反応と免疫寛容に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 214373 | |
| 報告番号 | 乙14373 | |
| 学位授与日 | 1999.06.23 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第14373号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | ヒトムチンタンパクの一種MUC1は腫瘍関連抗原の一種で、膵癌をはじめ乳癌、卵巣癌などにおいて過剰発現され、またo-グリコシル化が低下していることから癌に対する免疫療法の有効な標的と考えられている。本来ヒトは自己抗原であるMUC1に対して免疫寛容であるはずであるが、膵癌、乳癌、卵巣癌の患者の癌所属リンパ節からMUC1特異的細胞障害性T細胞が検出されていること、また上記癌患者の血清中にMUC1に対する抗体が検出されていることから、癌に発現されているMUC1に対しては免疫寛容ではなく、癌特異的な免疫療法の可能性が指摘されている。しかしながら、MUC1に対する免疫応答および寛容に関する基礎的な免疫機構に関する知見は得られていない。また、免疫応答および寛容を臓器特異的に調べた報告もない。本研究の目的は、(1)膵における臓器特異的なMUC1に対する免疫応答および寛容についての免疫機構を研究するための細胞株同所注入モデルの確立(2)膵の微小環境におけるMUC1に対する免疫機構の認識の有無の検索、および皮下におけるMUC1の認識との比較(3)皮下において惹起されたMUC1特異的な免疫反応が膵内腫瘍細胞の拒絶に対して有効であるかどうかの検討(4)どの免疫機構がMUC1発現膵内腫瘍細胞に対する拒絶反応を司っているかを探究することである。 目的(1)および(2)に対し、野生C57BL/6マウスおよびそのMUC1トランスジェニックマウス(以下、MUC1.Tg)と、同系由来膵癌細胞株Panc02を用いた。Panc02にはMUC1cDNAの遺伝子導入を行ない、同時にMUC1cDNAを含まないベクターのみの遺伝子導入株を対照として作成した。それらの細胞の腫瘍懸濁液を用いて膵内腫瘍細胞同所注入を施行した。目的(3)に対し、MUC1発現細胞による皮下免疫を上記遺伝子導入細胞株の細胞懸濁液により施行した。免疫細胞の養子免疫は以下の方法で施行した。ドナーマウスをMUC1発現細胞にて皮下免疫し、定められた期間経過後犠死させ、その脾臓とリンパ節細胞を受容者マウスに腹腔内注入した。翌日腫瘍細胞懸濁液を膵内同所注入した。目的(4)に対し、MUC1に対する液性免疫の検討を、MUC1発現細胞株を膵内注入されたマウスの血清中のMUC1反復配列に対する抗体価をELISA法にて検出することにより施行した。またMUC1に対する細胞性免疫の検討を、抗マウスCD4,CD8抗体溶液を腹腔内注入することにより得られるCD4+/CD8+T細胞除去マウスモデルを使用して行なった。 (1)膵内同所移植:最大30 (2)膵におけるMUC1に対する免疫応答:同数の細胞を膵内注入した場合では、MUC1発現細胞株による腫瘍増生が対照細胞より遅かった。しかしながらMUC1.Tgマウスを用いた実験ではMUC1発現細胞株と対照細胞株の間に腫瘍増生速度の差を認めなかった。皮下モデルと膵内モデルの比較においては、両細胞株とも膵内モデルにおいてより速く腫瘍を形成した。 (3)皮下にて惹起した免疫反応の膵内腫瘍細胞に対する有効性:野生マウスをMUC1発現細胞株にて皮下免疫し、のちに同細胞株を膵内同所注入した。免疫群において、膵内注入されたMUC1発現細胞株は腫瘍増生の拒絶を受けたが、膵内注入された対照細胞株は非免疫群に比べてわずかに大きな腫瘍増生の拒絶を受けたのみであった。皮下免疫から膵内同所注入までの期間を3週間と5週間の2種類に設定して実験を行なった比較では、3週間の間隔がMUC1発現細胞株に対する腫瘍増生の拒絶には有効であった。 ドナー野生マウスの免疫細胞を養子免疫により受容者野生マウスに移植した実験では、受容者野生マウスにおいてMUC1発現細胞株の腫瘍増生に対する拒絶への養子免疫の効果が見られた。養子免疫の効果は対照細胞株の腫瘍増生に対しては見られなかった。同様の結果が、ドナー野生マウスの免疫細胞を養子免疫により受容者MUC1.Tgマウスに移植する実験においても得られた。ドナー野生マウスからの免疫細胞が受容者MUC1.Tgマウスの組織において発現されている内因性MUC1を攻撃し認識する自己免疫反応は見られなかった。 ドナーMUC1.Tgマウスの免疫細胞を養子免疫により受容者野生マウスに移植した実験では、受容者野生マウスにおいてMUC1発現細胞株および対照細胞株の腫瘍増生に対する拒絶への養子免疫の効果は検出できなかった。 (4)MUC1発現腫瘍への拒絶反応に対する液性免疫、細胞性免疫の関与:MUC1に対するマウス血中抗体価の検討では、比較的高い抗体価を示した野生マウスは比較的早く死亡し、一方腫瘍を拒絶したマウスの抗体価は低かった。また、CD4+,CD8+T細胞の除去実験においては、いずれの細胞を除去した場合でも生存曲線の悪化を認め、両者を除去された野生マウスにおける生存曲線はMUC1.Tgマウスのそれとほぼ同等であった。 本研究においてはまず、C57BI/6マウスにおける同系膵癌細胞株を用いた同所注入モデルを確立した。膵内同所移植モデルの報告はあるがいずれもT細胞系を欠くヌードマウスを用いた研究であり、MUC1に対する腫瘍免疫の研究に対する適切な実験系とはなりえない。また腫瘍免疫の研究モデルにおいては通常腫瘍細胞を皮下に注入するが、皮下は抗原提示細胞やその他の免疫担当細胞に富んでおり、癌本来の場所(膵癌であれば膵臓)における腫瘍免疫の状態と必ずしも一致しないと考えられる。癌抗原に対する免疫応答、免疫寛容を臓器特異的に検討した報告はない。本研究において確立した同所注入モデルは以上の意味においてそれ自体有意義なものと考えられる。 このモデルと、MUC1遺伝子導入膵癌細胞株を用いて膵におけるMUC1特異的免疫反応を探った。野生マウスはMUC1発現株を拒絶し、またMUC1.TgマウスはMUC1発現株を拒絶できなかった。これらの結果から、野生マウスは膵においてMUC1を認識し免疫学的拒絶反応を惹起することができ、MUC1.Tgマウスは膵に提示されたMUC1に対して免疫学的寛容であることが示された。 次に、臨床応用の視点から、皮下にて惹起されたMUC1に対する免疫反応が、膵におけるMUC1発現腫瘍細胞の増生を抑制するかどうかを検討した。(1)皮下にてMUC1発現細胞を用いて免疫し、一定期間後MUC1発現細胞を膵内同所注入する(2)皮下にてMUC1発現細胞を用いて免疫し、一定期間後このマウスを養子免疫のドナーとして犠死させ免疫細胞を受容者マウスに移植したのち、受容者マウスに対しMUC1発現細胞を膵内同所注入するの2種類の方法にて、皮下にて惹起されたMUC1に対する免疫反応が膵におけるMUC1発現腫瘍細胞の増生を抑制した。後者の方法においてはさらに加えて、受容者がMUC1.Tgマウスの場合であっても免疫細胞の養子免疫は膵内注入されたMUC1発現腫瘍細胞の増生をMUC1特異的免疫反応により抑制した。MUC1.TgマウスはMUC1に対する免疫寛容を持つ点においてヒトと同様であり、上記の免疫応答はヒト膵癌への養子免疫療法の可能性を示唆する所見と考えられた。 最後にMUC1に対する免疫応答の機構の検討であるが、MUC1に対する血中抗体価が高いマウスの予後が悪く、予後のよいマウスの抗体価は低いという結果から、液性免疫はMUC1発現腫瘍細胞に対する腫瘍免疫には役立たないと考えられた。一方細胞性免疫の面ではCD4+,CD8+T細胞のいずれもが腫瘍拒絶に関与し、また、この両者を除去された状態ではMUC1に対する免疫反応がほとんど見られず腫瘍を拒絶できないことが判明した。 (1)C57B1/6マウスおよび同系膵癌細胞株を用いた膵内腫瘍細胞同所注入モデルを確立した。 (2)C57B1/6野生マウスは膵においてMUC1を認識し免疫学的拒絶反応を惹起することができ、C57B1/6MUC1トランスジェニックマウスは膵に提示されたMUC1に対して免疫学的寛容であった。 (3)C57B1/6野生マウスの皮下にて惹起されたMUC1に対する免疫反応が、膵におけるMUC1発現腫瘍細胞の増生を抑制した。 (4)腫瘍細胞の発現するMUC1に対する膵における免疫応答はCD4+,CD8+T細胞を主とする細胞性免疫が司っていると考えられた。 | |
| 審査要旨 | 本研究はムチンタンパクの一種であるMUC1に対する臓器特異的な免疫応答および免疫寛容を解析した。MUC1は腫瘍関連抗原の一種で、膵癌をはじめ乳癌、卵巣癌などにおいて過剰発現され、癌に対する免疫療法の有望な標的と考えられている。本研究においては以下の結果が得られている。 (1)C57B1/6マウスおよび同系膵癌細胞株を用いた膵内腫瘍細胞同所注入モデルを確立した。最大30 (2)膵におけるMUC1に対する免疫応答を検討した。同数の細胞を膵内注入した場合では、MUC1発現細胞株による腫瘍増生が対照細胞より遅く、C57B1/6野生マウスは膵においてMUC1を認識し免疫学的拒絶反応を惹起することができた。しかし、C57B1/6 MUC1トランスジェニック(MUC1.Tg)マウスを用いた実験では、MUC1発現細胞株と対照細胞株の間に腫瘍増生速度の差を認めず、MUC1.Tgマウスは膵に提示されたMUC1に対して免疫学的寛容であった。 (3)皮下にて惹起した免疫反応の膵内腫瘍細胞増生に対する有効性を検討した。野生マウスをMUC1発現細胞株にて皮下免疫し、のちに同細胞株を膵内同所注入した。免疫群では非免疫群に比べ、膵内注入されたMUC1発現細胞株は腫瘍増生に対するより大きな拒絶を受けた。また、MUC1発現細胞株にて皮下免疫されたドナー野生マウスの免疫細胞を養子免疫により受容者野生マウスに移植した実験では、受容者野生マウスの膵においてMUC1発現細胞株の腫瘍増生に対する拒絶への養子免疫の効果が見られた。同様の結果が、ドナー野生マウスの免疫細胞を養子免疫により受容者MUC1.Tgマウスに移植する実験においても得られた。以上より、C57B1/6野生マウスの皮下にて惹起されたMUC1に対する免疫反応が、膵におけるMUC1発現腫瘍細胞の増生を抑制し、またその効果は養子免疫により移植可能であった。 (4)MUC1発現腫瘍への拒絶反応に対する液性免疫、細胞性免疫の関与を検討した。MUC1に対するマウス血中抗体価の検討では、比較的高い抗体価を示した野生マウスは比較的早く死亡し、一方腫瘍を拒絶したマウスの抗体価は低かったことより、液性免疫の関与は低いと考えられた。また、CD4+,CD8+T細胞の除去実験においては、いずれの細胞を除去した場合でも生存曲線の悪化を認め、両者を除去された野生マウスにおける生存曲線はMUC1.Tgマウスのそれとほぼ同等であった。従って、腫瘍細胞の発現するMUC1に対する膵における免疫応答は、CD4+,CD8+T細胞を主とする細胞性免疫が司っていると考えられた。 以上、本論文はMUC1に対する膵における臓器特異的免疫応答および免疫寛容を解析し、MUC1特異的な免疫応答を養子免疫にて移植することによる膵癌の養子免疫療法の可能性を示唆する基礎的所見を得ており、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/51123 |
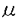 Lまでの腫瘍細胞懸濁液をリークなしに注入することが可能であり、術後急性合併症はみられなかった。多くのマウスが腹水による腹部膨満を示したのち7日以内に癌死した。剖検では直径10-15mmの易出血性腫瘍を膵に認め、若干の腹水を伴っていた。膵内注入細胞数を増加させると生存曲線が悪化した。
Lまでの腫瘍細胞懸濁液をリークなしに注入することが可能であり、術後急性合併症はみられなかった。多くのマウスが腹水による腹部膨満を示したのち7日以内に癌死した。剖検では直径10-15mmの易出血性腫瘍を膵に認め、若干の腹水を伴っていた。膵内注入細胞数を増加させると生存曲線が悪化した。