| 背景と目的 多細胞生物は、不要な細胞を能動的に排除するメカニズム-programed cell deathあるいはapoptosisと呼ばれる-を有している。一方では、apoptosisは、腫瘍の増殖、転移の制御に深く関与しており、全ての腫瘍においては何らかの形でapoptosisのメカニズムに障害があると考えられている。apoptosisの研究は、線虫(C.elegans)を研究対象として盛んに行われ、C.elegansの変異体の解析から、apoptosis誘導性のCED3,CED4、apoptosis抑制性のCED9のタンパク質などが次々に同定され、高等動物におけるそれらのhomologも単離同定されている。 Interleukin 1-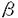 converting enzyme(ICE)は、高等動物のCED-3 homologとして同定されたシステインプロテアーゼで、マウスのICE遺伝子(mICE)を過剰発現させることにより異種由来を含む数種の細胞株でapoptosisを誘起することが報告され、機能的にもCED3と類似の働きをすることが示された。その後、ヒトやマウスにおいて同定された10種をこえるhomologsは一括してcaspasesと命名された。caspasesは、カスケードを構成しapoptosisの最終段階の実行蛋白として機能しているが、一つ一つのcaspaseはそれぞれやや異なった信号伝達の下流にあるらしく、ICEはその中でもよりin vivoの条件下で重要と思われるFas-FasLを介する系や、細胞接着に関するapoptosis誘起性信号によって作用するらしいと考えられている。 converting enzyme(ICE)は、高等動物のCED-3 homologとして同定されたシステインプロテアーゼで、マウスのICE遺伝子(mICE)を過剰発現させることにより異種由来を含む数種の細胞株でapoptosisを誘起することが報告され、機能的にもCED3と類似の働きをすることが示された。その後、ヒトやマウスにおいて同定された10種をこえるhomologsは一括してcaspasesと命名された。caspasesは、カスケードを構成しapoptosisの最終段階の実行蛋白として機能しているが、一つ一つのcaspaseはそれぞれやや異なった信号伝達の下流にあるらしく、ICEはその中でもよりin vivoの条件下で重要と思われるFas-FasLを介する系や、細胞接着に関するapoptosis誘起性信号によって作用するらしいと考えられている。 腫瘍におけるapoptosisメカニズムの障害とその増殖との関連を見ることは特にin vivoにおいて重要と思われる。apoptosisは栄養条件の悪化や免疫機構の介入など、in vivo特有の条件によって強く影響を受けると考えられるからである。 本研究では、以上の知見をふまえ、腎癌由来細胞を用いて、in vivoでの固形腫瘍の増殖におけるICEを介したapoptosisの関連を、in vitroと比較しつつ検討することを目的とした。 方法 マウスのICE(murine ICE-mICE)のcDNAを、chicken 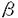 -actin promorterを有する発現ベクターpCAGGSに組み込み、マウス腎細胞癌由来株(Renca)に、リポゾーム法を用いてmICEを形質導入し、更にネオマイシン耐性遺伝子とのco-transfectionを行い、ネオマイシン(G418)含有培地(400mg/ml)で単離選別し、mICEをstableに強発現する細胞株を樹立した。ICEの発現は抗ICE抗体による免疫染色およびRT-PCRにより確認した。この細胞株を用い、in vitro,およびin vivoでの、増殖能を対照細胞(pCAGGS vectorのみを導入)と比較した.また、細胞環境の変化によって生じるapoptosisを、DNAの断片化の検出とTUNEL法により検証した。in vitroの増殖能は、MTTアッセイを用い、対照細胞との比較で相対的に評価した.in vivo実験系では、Renca由来細胞を、同種同系のBALB/cマウスの腎被膜下および皮下に移植して、形成される腫瘍径を測定した。 -actin promorterを有する発現ベクターpCAGGSに組み込み、マウス腎細胞癌由来株(Renca)に、リポゾーム法を用いてmICEを形質導入し、更にネオマイシン耐性遺伝子とのco-transfectionを行い、ネオマイシン(G418)含有培地(400mg/ml)で単離選別し、mICEをstableに強発現する細胞株を樹立した。ICEの発現は抗ICE抗体による免疫染色およびRT-PCRにより確認した。この細胞株を用い、in vitro,およびin vivoでの、増殖能を対照細胞(pCAGGS vectorのみを導入)と比較した.また、細胞環境の変化によって生じるapoptosisを、DNAの断片化の検出とTUNEL法により検証した。in vitroの増殖能は、MTTアッセイを用い、対照細胞との比較で相対的に評価した.in vivo実験系では、Renca由来細胞を、同種同系のBALB/cマウスの腎被膜下および皮下に移植して、形成される腫瘍径を測定した。 結果 Renca由来細胞へのmICE導入 Renca由来細胞は全て、RT-PCRで検出可能なレベルの内因性ICEを発現しており、増殖による細胞密度の増加に伴い自発性のapoptosisが起こり、DNAの断片化が観察された.mICE導入細胞株では、対照細胞に比し早期に、言い換えれば、低い細胞密度で、自発性のapoptosisが起こった.5×105の細胞を35mmシャーレに播き培養を開始すると、同じ培養条件で導入細胞(Renca ICE 1,2,3)では3日目から、対照細胞(Renca cont 1,2)では7日目から、DNAの断片化が観察された.Renca由来細胞の、MTTアッセイによるin vitroでの増殖能の比較では、導入細胞株と対照細胞株との差は、明らかにならなかった。しかし、in vivoの増殖能は、明確な差異を示した。同所性の移植による腫瘍径は、対照細胞の比較で、導入細胞で有意に小さかった(p=0.0205〜0.0466 unpaired t-test)。皮下移植による、腫瘍径の経時的観察では、まず、生着率に差が認められた。対照群(Renca cont 1)では、100%(n=6)で生着したが、導入細胞(Renca ICE1,3)の2群では、それぞれ63.6%(n=11)、16.7%(n=6)であった。 さらに生着のみられた個体の腫瘍径を、Renca ICE1群(n=7)とRenca cont 1群(n=6)で経時的に比較すると、2週目までは、ほとんど差はなかったが、3週目より有意な差が生じ(p=0.017)、5週目には、差が著明になった(p=0.0002 unpaired t-test)。Renca ICE1群では、個体により増大の停止や縮小が見られ、組織学的観察により広範なapoptosisを認めた。なお、Renca cont 1群では、腫瘍は、個体が死に至るまで無制限に増殖を続けた。この固形腫瘍で、内因性ICEの発現をRT-PCRにて検出したが、発現は認め得なかった。更に固形腫瘍として成立したRenca細胞を再び組織培養に戻してICEの発現を見ると、ICEはRT-PCRでも検出不能となっていた。これを脱メチル化薬剤である5-aza-2’-deoxycytidineで処理すると、再びICEの発現が見られ、かつ細胞はapoptosisを起こした。同様な事実がヒト腎癌細胞にも当てはまるか否かを見るために、ヒト腎癌由来細胞であるACHNおよびCaki 1で、ICEの発現レベルを調べた。Caki 1は培養条件下でICEを発現していたが、ACHNはICEを発現していなかった。ACHNを5-aza-2’-deoxycytidineで処理すると、ICEの発現が見られるようになり、細胞は容易にapoptosisを起こした。 考察 Renca細胞においてmICE導入細胞は、細胞密度の低い条件下では、apoptosisを誘起せず、MTTアッセイでは、細胞の増殖能にも影響を及ぼさなかった。しかし細胞密度が上昇し自発性のapoptosisが始まる段階では、導入細胞では、より早期にapoptosisが誘導された。以上の結果より、ICEの過剰発現は、直接的にapoptosisを引き起こすのではなく、apoptosisを誘導する刺激を増強すると考えるのが、妥当であると思われた。Renca由来細胞のin vivoの増殖については、in vitroの増殖とは、異なった結果が得られ、腫瘍の生着、増殖ともに、導入細胞で強く抑制された。導入細胞においては、増大を示した後で、逆に腫瘍径の縮小が認められる例もあった。これらの例においては、TUNEL法で広範な、apoptosisが認められた。 in vivoに注入された直後と、ある程度の大きさでかつ血管新生を伴わない固形腫瘍を形成する腫瘍細胞は、栄養、換気等の面で悪い環境にさらされる。in vitroでの自発性apoptosisと同様にin vivoにおいても、細胞の周辺環境の悪化が、感受性を増した導入細胞を刺激しapoptosisを誘起するというメカニズムが考えられた。 一方、対照細胞は、in vivoにおいては、宿主個体を死に至らしめるまで無制限に増殖を続けた。そしてこの腫瘍内の細胞では、RT-PCRによっても内因性ICEの発現は検出され得なかった。即ち、in vivoにおいては、内因性ICEの発現が、転写レベルで抑制され、これが、固形腫瘍の無制限な増殖を可能にしていると考えられた。この発現抑制のメカニズムの可能性の一つとして、DNAのメチル化が考えられることを我々の実験結果は示している。これは、マウスのみならず、ヒト腎癌由来細胞においても同様の結果を示し、腎癌にある程度共通する性質である可能性がある。このような、in vivoにおけるapoptotic pathwayとその障害のメカニズムは、in vitroの実験系のみでは捉えきれない側面を有すると考えられ、これを適切な実験系を用いてを解明していくことの重要性は、腎癌のみならず、他の固形腫瘍にも共通し、いまだに成績の芳しくない固形腫瘍の新たな治療戦略を考える上で極めて意義のあることと考える。 |