| 内容要旨 | | アフラトキシン(aflatoxin)は、強力な発ガン性を有するカビ毒として知られ、Aspergillus属のAspergillus flavus,Aspergillus parasiticus,Aspergillus nomius等により生産される。aflatoxin生産菌はピーナッツ等の農作物に感染し、熱帯や亜熱帯の環境条件下でaflatoxinを生産し作物を汚染する。aflatoxinに汚染された作物の恒常的な摂取は肝臓癌を引き起こし、現在、アジアやアフリカ等のaflatoxin高汚染地帯では、年間25万人に上る人々がaflatoxinが原因の肝臓癌により死亡していると推定されていろ。従って、農産物をaflatoxin汚染から守ることは安全な食糧を確保する上で重要な課題の一つであり、防除のための有効な薬剤の開発が急がれてきた。 aflatoxinの汚染を防除するには、第一に、生産者である真菌の生育を阻止する方法が考えられる。しかし、強力な抗真菌剤は植物や哺乳類に対する毒性も強いことが多く、又、その汎用による、これまで多くの抗生物質の使用で繰り返し見られてきた、早期の薬剤耐性菌の出現が懸念される。一方、aflatoxinは二次代謝産物として生産されることに注目すれば、その生合成を阻害しても生産菌の生育には影響を与えないと考えられる。従って、aflatoxinの生産は阻害するが生産菌の生育は阻害しないような物質が得られれば、高選択性の、耐性菌が出現しにくい薬剤となる可能性が高いと考えられる。 そこで、著者はaflatoxin生産菌であるA.prasiticusとaflatoxin高感受性菌株のBacillus megateriumを用いるバイオアッセイ法を開発しaflatoxin生産阻害特質の検索を試みた。その結果、Streptomyces属と同定された一放線菌の代謝産物中に阻害活性を見いだし、活性物質の単離、構造解析を行ったところ新規化合物と分かり、aflastatin Aと命名した。 本研究では、aflastatin Aの検索、生産菌の同定、aflastatin Aの単離、構造決定および、その類縁体であるaflastatin B、blasticidin Aの構造決定、並びにaflastatin Aの生合成、aflastatin類の生物活性について検討を行った。以下にその結果を要約する。 1.aflastatin Aの検索 atlatoxin生産を特異的に阻害する化合物を検索するため、Bacillus megaterium ATCC25848を用いたバイオアッセイを利用するスクリーニング方法を確立した。具体的には、土壌より分離した放線菌の培養瀘液を添加した液体培地に、aflatoxin生産菌を接種し培養後、その生育を観察した。次いで、B.megaterium ATCC25848を用いたペーパーディスク法によるバイオアッセイで、aflatoxin生産菌の生育阻害が見られなかった培養上清中のaflatoxin濃度を測定した。このスクリーニングにより新規aflatoxin生産阻害物質aflastatin Aを発見した。 2.aflastatin Aの生産菌 上記のaflastatin A生産菌であるMRI142株は、その胞子鎖が螺旋状で、胞子表面は棘状であり、培養の色調はGray seriesに属する。又、チロシン寒天培地上等でメラニン様色素を生産し、細胞壁ジアミノピメリン酸はLLタイプである。更に、炭素源としてL-ラムノースおよびシュークロースを資化しない。 これらの結果とその他の生理的性質から、MRI142株はStreptomyces griseochromogenesと類似の菌株であることが判明した。しかし、S.griseochromogenesのtype strainであるIFO13413株の炭素源資化性のパターンはMR1142株のそれと異なっていたため、MR1142株をS.griseochromogenesに類似する菌株であるStreptomyces sp.MR1142と同定した。 3.aflastatin類の発酵生産・単離 aflastatin類の発酵生産は、MRI142株をジャーファーメンターで培養して行い、その培養菌体からaflastatin類をメタノールで抽出した。その抽出液を濃縮後ブタノールに転溶し、炭酸水素ナトリウム水溶液で抽出洗浄した。そのブタノール溶液を乾固後テトラヒドロフラン等による溶媒沈澱を行いaflastatin類を含む沈澱を回収した。その沈澱を塩基性条件下の逆相HPLCにより分画精製してaflastatin AおよびBを単離した。 4.aflastatin A類およびblasticidin Aの構造決定 aflastatin AおよびBは無色の粉末で、その分子式はHR-FABMSスペクトルおよび各種NMRスペクトルの解析より、各々、C62H115O24NおよびC61H113O24Nと決定された。aflastatin類のUV吸収スペクトルはpH依存性であり、中性、塩基性溶液中では299および247nmに吸収極大を有し、酸性溶液中では314および237nmに極大がシフトした。又、IR吸収スペクトルには、3300-3400cm-1に水酸基由来、1600cm-1にカルポニル基または二重結合由来と思われる強い吸収が認められた。 aflastatin Aの構造は、各種NMRスペクトルの解析およびaflastatin Aの過沃素酸酸化により生成したフラグメント分子の構造解析等により図1に示すものであることが明らかとなった。更に、aflastatin BについてもHR-FABMSおよび各種NMRスペクトルの解析により、これがaflastatin AのN-デメチル体であることが判明した(図1)。 一方、blasticidin AはKono等1)によって単離された放線菌由来の抗生物質であり、その理化学的性質が、上記の単離・構造解析の過程で判明したaflastatin Aのものと類以していた。そこで、blasticidin Aのaflatoxin生産阻害活性を調べたところaflastatin Aと同様の活性を有していることが判明した。よって、構造未決定であったblasticidin Aについてもaflastatin Aと同様の手法によりその構造を明らかにした(図1)。  図1.aflastatin類の構造 図1.aflastatin類の構造 aflastatin類およびblasticidin Aの構造はtetramic acid骨格を有する直鎖状ポリオールという特異なものであった。 5.aflastatin Aの生合成 aflastatin Aは直鎖状ポリオール構造を有することから、ポリケタイド経路により生合成されることが予想された。しかし、その水酸基の一部は通常のポリケタイド経路からは生成が予測されないものであった。そこで、aflastatin Aの生合成を解明するため、13Cでラベルした酢酸、ブロピオン酸、グルコース、グリコール酸の取り込み実験を行い、その生合成が図2に示すものであることを明らかにした。特に、aflastatin Aには2分子のグリコール酸が連続して取り込まれ、その生合成は特異なものであった。 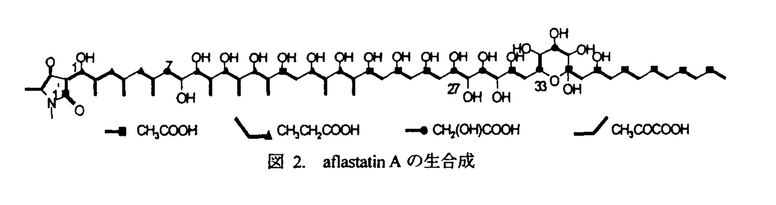 図2.aflastatin Aの生合成6.aflastation類およびblasticidin Aの生物活性 図2.aflastatin Aの生合成6.aflastation類およびblasticidin Aの生物活性 aflastatin Aを0.5 g/mlの濃度で液体培地に添加してaflatoxin生産菌を培養した場合、培養後の菌体重量の増加は対照と同等で、一方、aflatoxin生産は完全に抑制された。又、寒天培地上においても、aflastatin Aを0.5 g/mlの濃度で液体培地に添加してaflatoxin生産菌を培養した場合、培養後の菌体重量の増加は対照と同等で、一方、aflatoxin生産は完全に抑制された。又、寒天培地上においても、aflastatin Aを0.5 g/mlの濃度で添加することで、aflatoxin生産菌にょるaflatoxin生産は完全に抑制された。このとき菌叢の肥厚化とコロニー直径の若干の減少が認められたためaflastatin Aはaflatoxin生産菌の形態に影響を及ぼす可能性が示唆されたが、aflastatin Aはaflatoxin生産を特異的に阻害することが確認された。 g/mlの濃度で添加することで、aflatoxin生産菌にょるaflatoxin生産は完全に抑制された。このとき菌叢の肥厚化とコロニー直径の若干の減少が認められたためaflastatin Aはaflatoxin生産菌の形態に影響を及ぼす可能性が示唆されたが、aflastatin Aはaflatoxin生産を特異的に阻害することが確認された。 なお、aflastatin Bおよびblasticidin Aもaflastatin Aと同様の生理活性を有していた。 引用文献1) Kono,Y.,Takeuchi,S.and Yonehara,H.:J.Antibiot.,21,433-438(1968) |
| 審査要旨 | | アフラトキシン(aflatoxin)は数種のAspergillus属のカビが生産する強力な発癌性を有する毒性化合物である。熱帯,亜熱帯地域では,これら生産菌がピーナツなどの農作物に感染することによってアフラトキシンに汚染され.そのような作物を摂取すると肝臓癌が引き起こされることがわかっている。本研究はアフラトキシン生産菌の生育を阻害することなく.アフラトキシンの生産のみを特異的に阻害する化合物を見い出し.その構造解析と生物活性を述べたもので,緒言のはか3章がらなる. 緒言では,ポリケチド生合成経路を経て二次代謝物として合成されるアフラトキシンの汚染は世界的に食品衛生上極めて重大な問題であり,その対策を急ぐ必要があるが,これまでそれに対する有効な対策は見つかっていないことを述べている。 第1章では,アフラトキシン生産を特異的に阻害する化合物を検索する方法を確立し,それを用いて土壌から分離した放線菌をスクリーニングした結果,目的の活性を有する化合物を生産する菌株を得たことを述べている。すなわち,アフラトキシン生産菌Aspergillus parasiticus NRRL2999株に対して放線菌の培養ろ液を供し,まず生育を阻害するものを除外し,生育には影響を及ぼさなかったもののなかから,アフラトキシン生産を阻害するものを選択した。この際,アフラトキシン生産量は,アフラトキシン感受性であるBacillus megaterium ATCC25848株を用いたペーパーディスク法による簡便な方法によって測定した.このスクリーニング法により,神奈川県逗子市の土壌がら分離された一放線菌の培養ろ液に目的の活性を認めた。 第2章では,その放線菌の同定および活性物質の精製,構造解析,生合成と生物活性について述べている。活性物質の生産菌は形態,生理的性質,炭素源の資化性,細胞壁構成成分の分析等からStreptomyces sp.MR1142と同定した。MR1142株の培養条件を検討した後.培養菌体からメタノール抽出し.抽出液を溶媒分画.溶媒沈殿により粗精製した後,塩基性条件下で逆相HPLCにより2種類の活性物質を単離し,aflastatin AおよびBと命名した。それぞれの収量は培養液1リットルあたりそれぞれ125mg, 1.3mgであった。まず,主要成分であるaflastatin Aについて構造解析を行った。種々の機器分析データから分子式はC62H115O24Nと決定された。各種NMR解析から部分構造が推定され,過沃素酸酸化によって得られた分解物の構造解析と総合することにより,図1に示す構造であると決定した。すなわち,一端にはテトラミン酸骨格を,中央部に水酸基を多数もつ鎖状構造を,他端にはアルキル鎖を有する特異な構造であった。また,aflastatin Bの構造はaflastatin Aの分析データとの比較からaflastatin AのN-デメチル体であることがわかった。aflastatin Aはラベルした酢酸,プロビオン酸,グルコースおよびグリコール酸の取り込み実験の結果から.図2に示す様式で生合成されることがわかった。 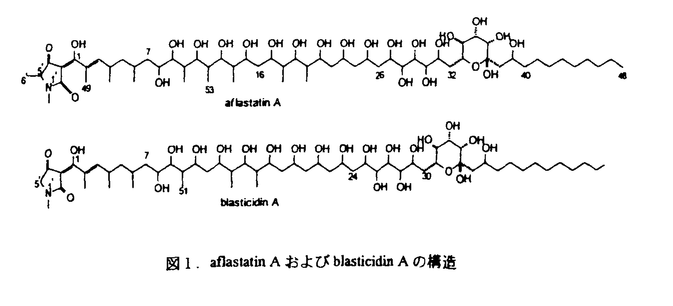 図1.aflastatin Aおよびblasticidin Aの構造 図1.aflastatin Aおよびblasticidin Aの構造 図2.aflastatin Aの生合成 図2.aflastatin Aの生合成 aflastatin Aはアフラトキシン生産菌であるA.parasiticus NRRL2999株に対して濃度依存的にアフラトキシン生産を阻害し,0.5 g/mlの濃度で完全に阻害したが,その濃度で菌体重量はaflastatin Aを添加しない対照と有意な差は認められなかった。 g/mlの濃度で完全に阻害したが,その濃度で菌体重量はaflastatin Aを添加しない対照と有意な差は認められなかった。 第3章では,1968年,KonoらによりStreptomyces griseochromogenesの培養菌体からイモチ病菌に対して強力な抗菌活性を有する化合物として単離されていたblasticidin Aの埋化学的性状がaflastatin類に類似しており,またそれがaflastatin Aと同様にアフラトキシン生産阻害活性を示すことが明らかなり.未だその構造が決定されていなかったことから,本化合物を単離し,構造を決定した。その結果,blasticidin Aはaflastatin類ときわめて類似の構造を有することがわかった(図1)。blasticidin Aのアフラトキシン生産阻害活性はaflastatin類と同程度であった。 以上,本論文はアフラトキシン生産菌の生育を阻害することなく,その二次代謝産物であるアフラトキシンの生産を特異的に阻害する物質のスクリーニング法を開発し,その方法を用いて特異な構造を有する新規化合物を得たものであり,学術上,応用上貢献するところが少なくない。よって,審査員一同は.本論文が博士(農学)の学位論文として価値あるものと認めた。 |