学位論文要旨
| No | 214415 | |
| 著者(漢字) | 田中,竜平 | |
| 著者(英字) | ||
| 著者(カナ) | タナカ,リュウヘイ | |
| 標題(和) | 健常人ドナーにおけるrHuG-CSF投与後の末梢血前駆/幹細胞の性状解析 : ヒト巨核球系前駆細胞を含めた末梢血前駆/幹細胞の評価と同種末梢血幹細胞移植への展望 | |
| 標題(洋) | ||
| 報告番号 | 214415 | |
| 報告番号 | 乙14415 | |
| 学位授与日 | 1999.09.08 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第14415号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 造血幹細胞(hematopoietic stem cell、HSC)の分化・増殖機構は、半固形培地中でのコロニー形成法が開発されたことによって、造血細胞の性状のみならず、その分化・増殖に関わる因子(サイトカイン)についてもその詳細な検討が可能となった。 HSCについて、器官発生学として基礎的な検討が加えられる一方、組織適合性抗原の理解に伴い、同種移植としての造血幹細胞移植(allogeneic hematopoietic stem cell transplantation、allo-HSCT)の臨床応用が積極的になされ、白血病、再生不良性貧血、あるいは先天性免疫不全症など、HSCの異常と理解される一連の難治性疾患群に対する根治的治療法として、その臨床的有用性が確立された。 また、HSCの臨床応用のひとつとして、自家幹細胞移植(auto-HSCT)があげられる。auto-HSCTを行うことによって骨髄抑制という副作用を度外視した大量化学療法が可能となり、auto-HSCTは癌化学療法の進歩に大きく貢献している。 現在のところHSCそのものは同定されておらず、従来のHSCTは専らHSCが存在する造血の場の移植、即ち、骨髄移植をもってそれとしていた。ところが、ヒト成人末梢血中にin vitroコロニー形成細胞(peripheral blood progenitor cell,PBPC)が存在し、それは癌化学療法後の造血回復期に著増する事が示されていたこと、また、これらPBPCは癌化学療法後の骨髄低形成期からの造血回復期だけではなくG-CSFやGM-CSFなどの造血因子投与後にも末梢血中に大量に動員されることが知られ、このPBPCを用いた自家移植(auto-PBPCT)併用大量化学療法が盛んに行われるようになった。 一方、最近では健常ドナーにG-CSFを投与し、末梢に動員された造血幹/前駆細胞を同種移植に応用する試みが報告されつつある。しかし、この同種末梢血幹/前駆細胞移植(allo-PBPCT)の臨床応用への経過を観ると、健常人ドナーのPBPCの性状や、その末梢血中での動態などの基礎検討が十分為されぬままに臨床応用が先行しているとの感が否めない。 HSCTでは、移植されたHSCが生着・増殖し末梢血球細胞が回復するまでの期間、患者に頻回、大量の血小板輸血を要することが多く、そこにかかる医療費や血液製剤使用に伴う潜在的な感染のリスクは今後の移植医療を考えるうえで大きな問題である。ところがPBPCTでは造血能回復が速やかなため、移植後の血小板輸血回数が従来の骨髄移植に比べ少なくてすみ、それらの問題をある程度解消しうることが報告されている。しかしながらPBPCTにおいて、なぜ血小板造血の回復が速やかであるのか、という疑問に答える研究はなされていない。 近年、種々の造血前駆細胞系列について、その性状や増殖・分化に関わるサイトカインが詳細に検討されているが、巨核球-血小板系の増殖・分化機構は、特にヒトに於いて巨核球コロニー形成法の困難さから、理解が遅れている。 本研究では末梢血中コロニー形成細胞の内、従来その評価対象となっていた顆粒球/マクロファージ系および赤芽球系前駆細胞に加え、巨核球系前駆細胞の定量的および定性的評価を行い、PBPCT後の迅速な血小板回復の要因を検索することとした。 すなわち、予備検討として、マウスおよびヒト造血細胞を用いて、前駆細胞から巨核球への増殖・分化にかかわるサイトカインの役割を解析し、ヒト巨核球コロニー形成に至適な培養条件を決定した後、健常日本人ボランティアにG-CSFを投与した際の安全性の検討ならびに、先に検討した培養系を用いて、G-CSF投与期間中の、巨核球系前駆細胞を含めたPBPCレベルの変動を明らかとし、さらに動員されたFBPCの性状とG-CSFの投与量との関係を、末梢血中CD34陽性(CD34+)細胞とその亜分画、及びコロニー形成法による前駆細胞測定系を用いて詳細に検討した。 予備検討としてマウス骨髄細胞を用いた無血清培養系にてIL-3、IL-6、SCFの巨核球系前駆細胞に対する作用を、それぞれ単独、あるいは組み合わせで検討した。巨核球系前駆細胞はIL-3が添加された培地に於いて、SCFを加えることによりその増殖が支持され、一方、IL-6を加えることによりその分化が促進された。 マウスで得られた結果をもとに、ヒト臍帯血CD34+細胞あるいは末梢血単核球を用いて、ヒト巨核球系前駆細胞の至適な培養法を検討した。ヒト巨核球系コロニー形成にとって、乏血小板血漿を添加した培地にIL-3、IL-6、SCFおよびEpoを加えた培養系が至適であると考えられた。 先の結果をふまえ、健常人ボランティアにG-CSFを投与し、その安全性の検討とともに、末梢血中に動員されたPBPCについて、幹細胞移植片の評価として従来行われてきた顆粒球系および赤芽球系前駆細胞の定量的評価に加え、巨核球系前駆細胞の定量的評価を行った。さらにCD34+細胞とその亜分画を抗CD33、CD38、およびHLA-DR抗体を用いて検討した。 G-CSFは連続7日間、1日1回の皮下投与とした。投与量は安全性、耐用性を確認するため段階的に100 通常、健常成人の骨髄細胞を培養しても巨核球系前駆細胞の頻度とその増殖能は今回検討したPBPCに較べ低値であることがほとんどであるが、G-CSFの投与により、末梢血中にはDay5をピークとして極めて増殖能の高い巨核球系前駆細胞が多数検出された。一般にG-CSFはin vitroで巨核球コロニーの成長を支持せず、in vivo投与でも血小板数の増加は観察されない。G-CSFは巨核球・血小板系に特に作用を示さず、臨床的にはほぼ顆粒球系にのみ作用を示すにもかかわらず、巨核球系前駆細胞を含め前駆細胞レベルにはmobilizationという非特異的な作用を及ぼすということは、mobilizationのメカニズムを考える上で重要な点である。すなわち、G-CSFを含めmobilizationの効果を有するサイトカインは造血幹/前駆細胞そのものに作用するのではなく、他の要因を介する間接的な作用で造血幹/前駆細胞を骨髄環境から末梢血中へmobilizeさせるものと考えるのが妥当であると思われる。 本研究ではG-CSFの耐容性を検討するため、ボランティアの安全性を確認しつつG-CSFの投与量を段階的に上昇させた。100および200 本研究に於いては100 今後これらの問題を解決し、ドナーにとって安全で負担の少ない造血幹細胞提供を可能とし、患者にとって治療成績の向上につながる有効な造血幹細胞移植療法を確立するため、緻密にデザインされた臨床研究の遂行が望まれる。 | |
| 審査要旨 | 近年、自家末梢血幹細胞移植(auto-PBPCT)が癌化学療法に盛んに利用されるようになり、さらに最近ではヒト顆粒球刺激因子(rHuG-CSF)を健常人へ投与することによって同種末梢血幹細胞移植(allo-PBPCT)が臨床応用されつつある。 本研究では、これまで十分な基礎検討がなされぬまま臨床応用されている健常人の末梢血造血前駆/幹細胞の性状について検討を加えた。 すなわち末梢血中造血前駆細胞の内、従来その評価対象となっていた顆粒球/マクロファージ系および赤血球系前駆細胞に加え、巨核球系前駆細胞の定量的および定性的評価を行い、PBPCT後の迅速な血小板回復の要因を検索することと、健常日本人ボランティアにG-CSFを投与した際の安全性の検討ならびに、予備検討にて決定した培養系を用いて、G-CSF投与期間中の、巨核球系前駆細胞を含めたPBPCレベルの変動を明らかとした。さらに動員されたPBPCの性状とG-CSFの投与量との関係を、末梢血中CD34陽性(CD34+)細胞とその亜分画、及びコロニー形成法による前駆細胞測定系を用いて詳細に検討した。この研究により得られた主な結果は以下のようなものである。 1.予備検討にて、従来困難とされたヒト巨核球コロニー形成法の至適な培養条件を、マウスおよびヒト造血細胞を用いて決定した。すなわち、マウスおよびヒト造血前駆細胞を用い、無血清あるいはヒト乏血小板血漿を添加した培養系で、巨核球系前駆細胞の増殖・分化に於ける種々のサイトカインの意義について解析した。巨核球系前駆細胞はIL-3が添加された培地に於いて、SCFを加えることによりその増殖が支持され、一方、IL-6を加えることによりその分化が促進された。これらの検討からヒト巨核球系前駆細胞の定量的評価法として、ヒト乏血小板血漿を添加した培養系に、増殖因子としてIL-3、IL-6、SCF、およびEpoを用いる培養系が優れていると考えられた。 2.健常人ボランティアにG-CSFを投与し、その安全性の検討とともに、末梢血中に動員されたPBPCについて、幹細胞移植片の評価として従来行われてきた顆粒球系および赤芽球系前駆細胞の定量的評価に加え、先に確立した培養系を用い、巨核球系前駆細胞の定量的評価を行った。さらにCD34+細胞とその亜分画を抗CD33、CD38、およびHLA-DR抗体を用いて検討した。 G-CSFは連続7日間、1日1回の皮下投与とした。投与量は安全性、耐用性を確認するため段階的に100mg/m2,200mg/m2さらに400mg/m2へのdose-escalationを行うこととし、各用量に被験者を順次10名ずつ割り付けた。400mg/m2投与群では全例で耐容不能な骨痛および筋肉痛のため継続投与不能であった。従って100および200mg/m2投与群について動員されたPBPCの解析を行った。 3.健常人にG-CSFを投与すると末梢血中PBPCは顆粒球系および赤芽球系前駆細胞のみならず、増殖能の高い巨核球系前駆細胞が投与5日目にピークを示して大量に動員されることが判明し、PBPCT後の速やかな血小板回復の要因のひとつが明らかとなった。さらに、未分化前駆細胞と考えられるCFU-Mixや、CD34+/CD33-、およびCD34+/HLA-DR-分画を含め末梢血造血前駆/幹細胞の動員効率は100mg/m2投与群に較べ、200mg/m2投与群で有意に高く、G-CSFの投与量との間に用量依存性があると考えられた。 以上、本研究は健常人へG-CSFを投与した際にG-CSFの用量依存性に巨核球系前駆細胞を含めた種々の造血前駆細胞が動員されることを明らかとした。またこれまで示されていなかったG-CSFの投与量と末梢血造血前駆/幹細胞の未分化度の関係をも明らかとし、今後の同種末梢血幹細胞移植療法の発展に重要な貢献をもたらすものと思われ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/51128 |
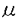 g/m2,200
g/m2,200