日本や欧米は高齢化社会を迎え、心筋梗塞をはじめとする血栓塞栓症疾患は年々増加している。そこで、その予防および治療に対する積極的な対策が求められ、生活習慣の改善・血栓形成の予防・治療薬の開発が求められている。血栓症における血栓形成の原因は、主に血小板粘着および血小板凝集が挙げられるが、その分子機構は未だ不明な点が多く、新機序の抗血栓症薬、特に、抗血小板薬の開発には、血小板機能の分子機構を解明することが重要であると考えられる。 古来より、蛇毒には、血小板凝集を阻害する生理活性物質が豊富に含まれていることが知られており、それらの単離精製・生化学的性質および作用機序を明確にすることは、血小板凝集における蛇毒蛋白質の生物学的機能を解明するだけでなく、血小板機能の分子機構を解明する有用なアプローチとなると考えられる。さらに、その成果は、新規抗血小板薬の研究開発へつながることが期待され、本研究を実施した。本研究では、クサリヘビ科の蛇毒より血小板粘着および凝集に関与する血小板膜糖蛋白GPIbと血漿蛋白vWFまたは血小板膜糖蛋白GPIIb/IIIaと凝集因子フィブリノーゲン、それぞれの蛋白結合を阻害する新規蛇毒蛋白質を単離精製し、その生化学的性質および作用機序を明らかにすることにより、血小板機能の分子機構の解明および蛇毒蛋白質の抗血小板薬への応用の可能性を追求した。 第一に、Trimeresurus flavoviridis毒より、ADP惹起血小板凝集を強力に阻害する新規蛇毒蛋白質を単離精製し、フラボスタチンと命名した。フラボスタチンは、ADP、コラーゲンまたはTRAP刺激による血小板凝集およびずり応力惹起血小板凝集を強く阻害した。一方、vWF依存性血小板凝集には影響せず、フィブリノーゲン依存性血小板凝集を特異的に阻害したことから、本物質はGPIIb/IIIaに結合することによりフィブリノーゲンの結合を阻害するものと考えられた。ついで、本物質の全アミノ酸配列を決定し、一次構造を明らかにした。本物質は、68残基のアミノ酸からなる一本鎖ポリペプチドであり、アミノ酸配列の相同性、RGD配列の存在およびCys残基の保存性から蛇毒ディスインテグリンファミリーの一員であることが示唆された。 第二に、vWF依存性血小板凝集を阻害する活性を指標に、フラボスタチンとは異なる機序、すなわち、GPIb-vWF結合阻害物質の単離精製を試み、Tr.flavoviridis毒よりフラボセチンAおよびB、Tr.tokarensis毒よりトカラセチンを単離精製することに成功した。フラボセチンAは分子量149kDaの高分子蛋白質で17および14kDaの2つのサブユニットからなるヘテロオリゴマーであり、フラボセチンBは分子量139kDaで17、15および14kDaの3つのサブユニットからなるヘテロオリゴマーであった。トカラセチンは、16および15kDaの2つのサブユニットからなる分子量29kDaのヘテロダイマーであった。ついで、Bothrops jararaca毒から既に精製単離されているjararaca GPIb-Binding Protein(以下、BPと略)とこれらの精製蛋白質の生化学的性質を比較検討した。Jararaca GPIb-BP、フラボセチンA、フラボセチンBおよびトカラセチンは、ヒト多血小板血漿を用いたリストセチンおよびボトロセチン惹起vWF依存性血小板凝集を強力に阻害したが、ADPやコラーゲン惹起フィブリノーゲン依存性血小板凝集には影響を及ぼさなかったことから、本蛋白質は、vWF依存性血小板凝集を特異的に阻害していることが示唆された。これらの蛋白質は、血小板に可逆的かつ特異的に結合すること、その結合は、GPIb上のvWF結合部位を認識する抗GPIbモノクロナール抗体GUR83-35により完全に阻害されることから、血小板膜上のGPIbに特異的に結合していると考えられた。また、これらの蛋白質は、血小板agglutination作用やセロトニン放出作用はなく、蛋白質自体に血小板凝集惹起作用はないことから、GPIbに特異的に結合し、vWF依存性血小板凝集のみを特異的に阻害することを明らかにできた。さらに、本蛋白質は、生体内の血栓症病巣部位、例えば冠状動脈狭窄部位での血流状態をin vitroで反映しているとされる高ずり応力惹起血小板凝集をも1-3 g/mlの濃度で完全に阻害した。 g/mlの濃度で完全に阻害した。 一方、これまでjararaca GPIb-BPの一次構造の解明はされておらず、今回、始めて全アミノ酸配列を決定した。本蛋白質は、142残基のアミノ酸を有する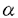 鎖と123残基のアミノ酸を有する 鎖と123残基のアミノ酸を有する 鎖からなるヘテロダイマーであり、 鎖からなるヘテロダイマーであり、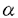 鎖と 鎖と 鎖の間に相同性(38%)があり、また、ボトロセチン、蛇毒GPIb結合蛋白質であるCHH-Bおよびエキセチン 鎖の間に相同性(38%)があり、また、ボトロセチン、蛇毒GPIb結合蛋白質であるCHH-Bおよびエキセチン 鎖と高い相同性(38-64%)が認められた。 鎖と高い相同性(38-64%)が認められた。 つぎに、jararaca GPIb-BPの活性サブユニットを同定するため、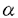 鎖および 鎖および 鎖に分離し、jararaca GPIb-BPとヒト洗浄血小板との結合に対する阻害活性を検討した。その結果、 鎖に分離し、jararaca GPIb-BPとヒト洗浄血小板との結合に対する阻害活性を検討した。その結果、 鎖のみに濃度依存的な結合阻害活性が認められ、 鎖のみに濃度依存的な結合阻害活性が認められ、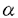 鎖は結合にほとんど影響を及ぼさなかったことから、jararaca GPIb-BPのGPIb結合部位は、 鎖は結合にほとんど影響を及ぼさなかったことから、jararaca GPIb-BPのGPIb結合部位は、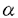 鎖ではなく、 鎖ではなく、 鎖に存在することが示唆された。さらに、 鎖に存在することが示唆された。さらに、 鎖の結合阻害活性が 鎖の結合阻害活性が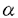 鎖との分離前の1/30に低下していたことから、本蛋白質の高次構造が結合阻害活性に大きく寄与していると考えられた。 鎖との分離前の1/30に低下していたことから、本蛋白質の高次構造が結合阻害活性に大きく寄与していると考えられた。 エキセチンは、 鎖に結合阻害活性があることが報告されている。エキセチン 鎖に結合阻害活性があることが報告されている。エキセチン 鎖とJararaca GPIb-BP 鎖とJararaca GPIb-BP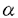 鎖および 鎖および 鎖の相同性は38%および52-54%であり、結合阻害活性のある 鎖の相同性は38%および52-54%であり、結合阻害活性のある 鎖の相同性が高いことは興味深い。しかし、本研究において、jararaca GPIb-BPのGPIbとの結合に関与する配列を特定することはできなかった。今後、jararaca GPIb-BP 鎖の相同性が高いことは興味深い。しかし、本研究において、jararaca GPIb-BPのGPIbとの結合に関与する配列を特定することはできなかった。今後、jararaca GPIb-BP 鎖に関する構造機能相関が明らかになればドラッグデザインにより低分子GPIb拮抗剤の創製へと発展することが期待される。 鎖に関する構造機能相関が明らかになればドラッグデザインにより低分子GPIb拮抗剤の創製へと発展することが期待される。 最後に、各種蛇毒GPIb結合蛋白質のin vivoにおける薬理作用を検討した。これまでの検討結果より、これらの蛋白質の生理活性には、サブユニット構造が大きく関与することが考えられたため、インタクトな分子100 g/kgのマウスへの静脈内投与により、その薬理作用を検討した。ところが、有意な血小板数の減少が認められた以外、各種の血液学的パラメーターには変化がなかったことから、血小板特異的に作用していることが示唆された。抗GPIbモノクロナール抗体や他の蛇毒蛋白質の投与による血小板減少は、これまでにも報告されているが、その機序は未だ不明である。 g/kgのマウスへの静脈内投与により、その薬理作用を検討した。ところが、有意な血小板数の減少が認められた以外、各種の血液学的パラメーターには変化がなかったことから、血小板特異的に作用していることが示唆された。抗GPIbモノクロナール抗体や他の蛇毒蛋白質の投与による血小板減少は、これまでにも報告されているが、その機序は未だ不明である。 ついで、血小板減少と著者が発見同定した蛇毒蛋白質の構造との関係を明らかにするため、フラボセチンBの構造改変による血小板減少に対する影響についても検討した。まず、フラボセチンBの還元アルキル化処理を試みた結果、in vitroでのvWF依存性血小板凝集阻害活性は、還元前の1/30-1/100と大きく低下した。この結果は、フラボセチンBの高次構造が上記阻害活性発現に大きく寄与していると同時に、高次構造に依存しない一次配列にも弱いながらも阻害活性があることを示している。そこで、還元アルキル化フラボセチンBをマウスに静脈内投与し、血小板減少に対する作用を検討した。蛇毒GPIb結合蛋白質が血小板数を有意に減少させる100 g/kgの60倍の用量である6mg/kgの還元アルキル化フラボセチンBをマウスに静脈内投与しても、血小板数の減少は全く認められなかった。すなわち、還元アルキル化フラボセチンBの高次構造に依存しないvWF依存性血小板凝集阻害活性は、血小板減少とは相関しないことが示唆された。一方、他の3種の蛇毒蛋白質は副作用が強いことから、in vivoにおける薬理作用を評価することは困難であったが、還元アルキル化フラボセチンBは、vWF依存性血小板凝集阻害活性に大きな減弱があるものの血小板減少を回避したことから、蛇毒蛋白質の高次構造に血小板減少と強い関係があることが推察された。したがって、今後、蛇毒GPIb結合蛋白質のサブユニットに局在するvWF依存性血小板凝集阻害に関わる最小活性部位を同定し、それを薬剤としてデザインすれば、GPIbとvWFの相互作用を阻害する活性を保ったまま、副作用としての血小板減少を回避した抗血小板薬となる可能性が示唆された。 g/kgの60倍の用量である6mg/kgの還元アルキル化フラボセチンBをマウスに静脈内投与しても、血小板数の減少は全く認められなかった。すなわち、還元アルキル化フラボセチンBの高次構造に依存しないvWF依存性血小板凝集阻害活性は、血小板減少とは相関しないことが示唆された。一方、他の3種の蛇毒蛋白質は副作用が強いことから、in vivoにおける薬理作用を評価することは困難であったが、還元アルキル化フラボセチンBは、vWF依存性血小板凝集阻害活性に大きな減弱があるものの血小板減少を回避したことから、蛇毒蛋白質の高次構造に血小板減少と強い関係があることが推察された。したがって、今後、蛇毒GPIb結合蛋白質のサブユニットに局在するvWF依存性血小板凝集阻害に関わる最小活性部位を同定し、それを薬剤としてデザインすれば、GPIbとvWFの相互作用を阻害する活性を保ったまま、副作用としての血小板減少を回避した抗血小板薬となる可能性が示唆された。 本研究において、抗血小板薬の創製を目的としてクサリヘビ科の蛇毒より血小板凝集を阻害する蛋白質を単離し、その生化学的性質および構造を明らかにした。蛇毒GPIb結合蛋白質は、蛋白質の構造を改変することなしに抗血小板薬として応用することは困難であった。しかしながら、これら蛇毒蛋白質は、受容体結合作用が強くかつ特異性が高いことからGPIb-vWFおよびGPIIb/IIIa-フィブリノーゲン相互作用の分子機構の解明および新規メカニズムによる抗血小板薬創製のための有用なツールとなると考えられた。 |