| 1.阻害解除型スレオニンデアミナーゼ遺伝子ilvA*の取得 E.coliにおけるL-イソロイシン生合成の経路及びその制御については、既に多くの研究があり、詳細に明らかにされている。E.coliにおいてL-イソロイシンを過剰生成させるには、その生合成の第一鍵酵素であるThreonine deaminase (TD)のL-イソロイシンによる阻害を解除し、更にL-バリンとの共通生合成酵素であるAcetohydroxy acid synthase (AHAS)のL-バリンによる制御を解除した株を造成することが必要であると考えられる。従来行われてきた遺伝子操作を用いるアミノ酸生産菌の育種では、目的アミノ酸のアナログに耐性な変異株等から得られる目的アミノ酸の生産株から、変異型の鍵酵素の遺伝子をクローニングして適当なベクターにて宿主に導入、強化する方法が採られてきたが、E.coli K-12においてはそのようなL-イソロイシン生産株は得られていなかった。そこでまず、ilvA欠損かつ制限系欠損かつrecA欠損の株を造成し、L-イソロイシン要求性の相補を指標として、E.coli MC1061株の染色体DNAから野生型ilvA遺伝子をクローニングした。得られたプラスミド(pILVA1)の保持株を、N-methyl-N’-nitro-N-nitrosoguanidine (NTG)にて変異処理を行い、プラスミドを抽出した。その中から、野生株に10mM Glycyl-L-leucine (GL)に対する耐性を与えるクローンとして、阻害解除型ilvA遺伝子を取得した。 得られた阻害解除変異遺伝子の発現するTDはin vitroでのL-イソロイシン濃度に対する阻害パターンから3グループに分けられたが、in vivoでL-イソロイシンを過剰生成、蓄積させるためには、L-イソロイシン非存在下での活性は野生型よりも低いが、L-イソロイシン濃度の増加に伴って活性がやや上昇してくるものが最も有利であり、必ずしも活性が高いことが有利なのではないことが判明した。阻害解除の様式として、L-イソロイシン濃度の増加に伴って活性が減少するのではなく、逆に活性が増加する性質が、トータルのL-イソロイシン発酵にとっては有利であるのではないかと考えられた。この変異型ilvA遺伝子をilvA*と名付け、以後の検討はこのilvA*遺伝子を用いて行った。 取得したilvA*遺伝子が実際にL-イソロイシンの生産に寄与することを確認するため、まず、歴史的に優秀なアミノ酸生産菌が育種されてきたBrevibacterium属細菌において、ilvA*遺伝子がコードする阻害解除型スレオニンデアミナーゼがその機能を発揮し、L-イソロイシンの過剰生成に寄与しうるか否かを試験した。 Brevibacterim中で機能するE.coliのtrpプロモーター下にilvA*遺伝子を発現するプラスミドpDRIA4を作製し、B.flavum野生株であるAJ1510株に導入したところ、pDRIA4導入株では、5倍以上のThreonine deaminase活性が得られ、L-イソロイシン1mM存在下での残存活性も著しく増大していた。このとき、野生株やベクターのみの導入株ではL-イソロイシンの培地への蓄積は見られなかったが、pDRIA4導入株では、約1.9g/lのL-イソロイシンが蓄積した。 培地に前駆体であるL-スレオニンと、更にその前駆体であるL-ホモセリンを加えた場合、培養後ほとんどが消失するが、野生株やベクターのみの導入株ではL-イソロイシンの蓄積にはほとんど至らないのに対し、pDRIA4導入株ではモルベースで約70%の効率でL-イソロイシンに転換した。これらのことは、E.coliのilvA*遺伝子にコードされる阻害解除型スレオニンデアミナーゼがB.flavum中で機能し、L-スレオニンやL-ホモセリンのL-イソロイシンへの転換、過剰生成に効果があることを示している。 実際に、B.flavumのL-スレオニン、L-ホモセリン両生産株TB-1にpDRIA4を導入すると、100g/lのグルコースから21g/lのL-スレオニンを蓄積する生産菌であるTB-1はL-スレオニンを蓄積しなくなり、代わってL-イソロイシンを約20g/l蓄積する、L-イソロイシン生産菌となり得た。 2.E.coli K-12系列株におけるL-イソロイシン生産菌の構築 L-イソロイシンの生合成はスレオニンデアミナーゼ(TD)の後、L-バリン生合成と共通の酵素であるアセトヒドロキシ酸シンターゼ(AHAS)、アセトヒドロキシ酸レダクトイソメラーゼ(RI)、ジヒドロキシ酸デヒドロゲナーゼ(DH)、トランスアミナーゼB(TA-B)を経て行われる。第二の律速段階であるAcetohydroxy acid synthase (AHAS)の、L-バリンによる阻害を受けないアイソザイムであるAHAS IIの遺伝子ilvGM(通常、E.coli K-12ではフレームシフト変異により機能していないが、復帰変異株MI162株よりクローニングした)と上記ilvA*遺伝子とを、E.coli K-12のL-スレオニン生産菌であるTDH6/pVIC40株にプラスミドによって導入すると、L-イソロイシン生産菌となったが、その生産効率は低かった。13C-NMRによる解析の結果、この状態では2つの中間体 , ,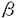 -dihydroxy- -dihydroxy-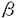 -methylvalerate (DHMV)と -methylvalerate (DHMV)と -keto- -keto-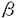 -methylvalerate (KMV)が、合わせてL-イソロイシンと同レベルの量蓄積することを見いだした。即ち、第一、第二律速段階であるTDとAHASを阻害解除型で強化すると、L-イソロイシン生合成の律速段階は、Dihydroxy acid dehydratase (DH,ilvD)とTransaminase-B (TA-B,ilvE)に移ること、AHASの次段であるDihydroxy acid reductoisomerase (RI,ilvC)は律速とはならないことが明らかとなった。 -methylvalerate (KMV)が、合わせてL-イソロイシンと同レベルの量蓄積することを見いだした。即ち、第一、第二律速段階であるTDとAHASを阻害解除型で強化すると、L-イソロイシン生合成の律速段階は、Dihydroxy acid dehydratase (DH,ilvD)とTransaminase-B (TA-B,ilvE)に移ること、AHASの次段であるDihydroxy acid reductoisomerase (RI,ilvC)は律速とはならないことが明らかとなった。 阻害解除TD、AHAS II、DH、TA-Bを同時に強化した株では、もはや中間体の蓄積はほとんど見られなくなり、阻害解除TDとAHAS IIのみを強化した株での蓄積中間体が滞留することなくL-イソロシシンにまで合成された場合に予想されるとおりに、L-イソロシシンの生産能は2倍となった。 このようにして造成されたL-イソロシシン生産菌TDH6/pVIC40,pMWD5株は、これまで報告されたSerratia marcescensやcoryneform bacteriaのL-イソロイシン生産菌株の収率を上回る最高収率(25%)を示す菌株となり得た。 3.基質のIleとValへの分配の改善とIle生成能の向上 一般論として、一定の原料から高効率で特定のアミノ酸を発酵生産しようとすれば、基質が副生物の生成に回るのを抑制することが望ましい。このために、アミノ酸生産菌の育種において目的アミノ酸以外の方向への生合成経路を遮断する操作がしばしば行われてきた。本研究でここまでに構築したIle高生産菌TDH6/pVIC40,pMWD5株は、Ile/Val共通系酵素を強化しているためか、最大の副生アミノ酸はValであった(Val/Ile重量比約12%)。IleはValと共通の生合成酵素で合成されるので、Val生合成経路を遮断する事による解決は原理的に不可能であり、生合成をValからIle側へ傾けることが必要であった。 AHAS反応における2つの反応生成物Acetohydroxy butyrateとAcetolactateの生成速度比が、基質である -ケト酪酸とピルビン酸の濃度比に比例するという、Barakらのin vitroでの結果をもとに、TDH6/pVIC40,pMWD5株と同様にAHAS II、DH、TA-Bを同時に強化した株の静止菌体を用いて、 -ケト酪酸とピルビン酸の濃度比に比例するという、Barakらのin vitroでの結果をもとに、TDH6/pVIC40,pMWD5株と同様にAHAS II、DH、TA-Bを同時に強化した株の静止菌体を用いて、 -ケト酪酸とピルビン酸からL-イソロイシンとL-バリンを生成するin vivoの実験を行い、 -ケト酪酸とピルビン酸からL-イソロイシンとL-バリンを生成するin vivoの実験を行い、 -ケト酪酸の供給がわずかに向上することでL-バリンの副生を抑え、L-イソロイシンの生成能を向上させ得ること、適切な -ケト酪酸の供給がわずかに向上することでL-バリンの副生を抑え、L-イソロイシンの生成能を向上させ得ること、適切な -ケト酪酸とピルビン酸の菌体内濃度比を実現できれば、生成Val/Ile重量比を10%未満に抑え得ることをin vivoにおいて示した。更にTDH6/pVIC40,pMWD5株のAK反応に於いてAK IIIの寄与が大きいことをつかみ、 -ケト酪酸とピルビン酸の菌体内濃度比を実現できれば、生成Val/Ile重量比を10%未満に抑え得ることをin vivoにおいて示した。更にTDH6/pVIC40,pMWD5株のAK反応に於いてAK IIIの寄与が大きいことをつかみ、 -ケト酪酸の供給量増加の手段として、尾川らの取得した阻害解除型AK IIIを導入したTDH6/pVICLC80A,pMWD5株を造成した。同株は、実際にL-バリンの副生が抑えられ、L-イソロイシンの生成能が向上して、その収率は30%に達した。 -ケト酪酸の供給量増加の手段として、尾川らの取得した阻害解除型AK IIIを導入したTDH6/pVICLC80A,pMWD5株を造成した。同株は、実際にL-バリンの副生が抑えられ、L-イソロイシンの生成能が向上して、その収率は30%に達した。 以上のように、新規な阻害解除型TD遺伝子ilvA*の取得、生合成fluxの解析に基づく律速部位の段階的な解除、生合成fluxのL-バリンからL-イソロイシンへの傾注を行い、糖からの生成効率がこれまで報告されたものを大きく上回る能力を持った、実用レベルのL-イソロイシン生産能をもつ菌株を、E.coli K-12にて造成することに成功した。 |