CD30はリンパ球活性化関連抗原として知られる。CD30を介したシグナルは、リンパ系細胞に対して増殖から細胞死といった多様な生物学的効果を有する。私はヒト骨髄性白血病細胞株におけるCD30の発現をノザン法で検討する過程で、骨髄性白血病細胞株HL-60を12-O-tetradecanoylphorbol 13-acetate(TPA)で刺激した際に誘導される、二つの新規のCD30 mRNAを発見した。これらのmRNAは2.3kbのサイズを有し、CD30の細胞外領域全体および膜貫通領域に対応するcDNAの一部を欠いており、CD30v mRNAと命名した。本研究は、このCD30の細胞外領域に対応する部分を欠く転写産物、CD30v mRNAのcDNAクローニング、およびそれより翻訳される蛋白質の構造および機能解析、さらに正常組織および白血病細胞における発現を検討したものである。 二種のCD30v cDNAがクローニングされ、長いcDNAクローンは2313bpでCD30の膜貫通部に対応する領域から下流の3’末端まで同一(CD30cDNAの1380から3630)であること、短いcDNAクローンは長いcDNAクローンから、その5’側近傍の54塩基の欠落(CD30 cDNAの1479から1532)を認めるものであった。短いcDNAクローンは54塩基の欠落によりフレームシフトは生じない為、これらの二つのcDNAのオープンリーディングフレームはCD30 mRNAと同一であった。オリゴキャップ法を用いた転写開始点の検討により、CD30v mRNAはCD30蛋白質の膜貫通部に対応するエクソンの上流に存在するイントロン領域から転写されることが示された。CD30v cDNAによりコードされる蛋白質はCD30の289番目のアミノ酸、塩基で1612番目から翻訳され、ちょうどCD30の細胞内領域C末端132アミノ酸からなっていた。したがって予想されるCD30v蛋白質は、CD30の細胞外領域および膜貫通領域を欠き、細胞質内領域C末端側の大部分からなるものである。 CD30v mRNAのin vitroでの翻訳では25kDaの蛋白として同定された。CD30の細胞質内領域に対して作製されたウサギポリクローナル抗体HCD30C1を用いたイムノブロットによる解析により、TPA刺激HL-60および二種類のCD30v cDNAをトランスフェクションされたCOS-7細胞において、CD30vは25kDaの蛋白質として同定された。 ノザン法によりヒト正常組織(心臓、脳、胎盤、肺、肝臓、骨格筋、腎臓、膵臓、脾臓、胸腺、前立腺、精巣、卵巣、小腸、大腸、末梢血単核球)におけるCD30vの発現を検討したところ、正常細胞では肺に発現を認めた。HCD30C1とCD30の細胞外領域を認識する抗体Ber-H2を用いた免疫染色による検討で、CD30vは肺胞マクロファージにおいて発現していることが示された。 構造解析により、CD30vはCD30の機能ドメインD1,D2,D3のすべてを含んでいることが示された。フォスファターゼを用いた脱リン酸化実験および正リン酸を用いたin vivo labelingにより、CD30vが構成的にリン酸化されており、CD30vがリン酸化を介した機能制御に関与している可能性が示唆された。NF-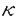 Bサイト依存性のレポーターを用いたreporter gene assayでは、CD30vがCD30と同様にNF- Bサイト依存性のレポーターを用いたreporter gene assayでは、CD30vがCD30と同様にNF-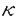 Bの活性化を誘導することが示された。HL-60にCD30vを過剰発現させるとNBT還元能の上昇を誘導した。これらの結果は、CD30vが機能分子として存在する可能性を示すものである。 Bの活性化を誘導することが示された。HL-60にCD30vを過剰発現させるとNBT還元能の上昇を誘導した。これらの結果は、CD30vが機能分子として存在する可能性を示すものである。 以上のことからCD30には細胞質外および膜貫通部を欠き、細胞内領域C末端側132アミノ酸からなるvariant form(構造異型体)が存在し、HL-60がTPAでマクロファージに分化する際に誘導されること、また肺胞マクロファージに発現していることから、当初単球一マクロファージ系細胞において発現、機能し得る分子と考えられた。 その後CD30vの翻訳開始点を認識する、CD30vを認識するがCD30は認識しない、ペプチドによるウサギポリクローナル抗体HCD30C2を作製した。これを用いた免疫染色で、CD30vはAMLの5例中2例(M3 0/1,M4 1/3,M5 1/1)で白血病細胞において発現していることが示された。さらにCD30v mRNAを特異的に検出するRT-PCRを用いた検討でも骨髄性白血病細胞、72例中52例で、リンパ性悪性腫瘍細胞、B細胞性90例中63例で、T細胞性の30例中7例で発現していることが示された。さらに一部の症例の白血病細胞について、ノザン法、イムノブロットを追加して検討したところ、CD30vの発現レベルはTPA刺激したHL-60と同等以上であった。これらのことはCD30vが白血病細胞に発現しうる分子であること、当初考えられたようにマクロファージ系細胞に限局した分子ではなく、広く血液系腫瘍において発現しうる分子であることを示唆している。 TRAF蛋白質はTNFレセプターファミリーのシグナル伝達分子として知られ、CD30のC末端、50アミノ酸に結合する。in vivoの共沈実験で、CD30vとTRAF2およびTRAF5が結合することが示された。白血病細胞におけるTRAF蛋白質のmRNAの発現をRT-PCRで検討しところ、TRAF1およびTRAF2は8例中6例、それぞれ(M0 1/1,M2 0/1,M4 0/1,M5 3/3,L1 1/1,ATL 1/1)と(M0 0/1,M2 0/1,M4 1/1,M5 3/3,L1 1/1,ATL 1/1)で、TRAF3および5は8例全てで発現していた。したがってTRAF蛋白質が白血病細胞においても発現、CD30vと結合し、シグナルを伝達する状況が整っていることが示唆された。 |