隆起性皮膚線維肉腫(dermatofibrosarcomaprotuberans:DFSP)は稀な軟部肉腫であり、しばしば再発を繰り返すが転移は稀である。そのため関連する腫瘍である良性の皮膚線維腫(dermatofibroma:DF)及び悪性の線維肉腫(fibrosarcoma:FS)や悪性線維性組織球腫(malignant fibrous histiocytoma:MFH)と比べ臨床的に中間悪性度の腫瘍として位置づけられている。これらの腫瘍は互いに類似した組織像を示すためしばしば診断に苦慮する。また中間悪性度に位置づけられるDFSPもその生物学的態度は症例により異なり、FSに類似する組織像を含むDFSPはDFSPwith fibrosarcoma tous area(DFSP-FS)と呼ばれ、その悪性度について議論が生じている。DFSPとDF、FS及びMFHは良性から悪性まで生物学的悪性度が著しく異なるため正確に診断することは重要であり、もし悪性度が定量的に評価できれば腫瘍の鑑別だけでなく効果的な治療や予後の推測が可能となる。 DFSPとこれらの腫瘍の鑑別に有用なマーカーとしてCD34(human progenitor cell antigen)や血液凝固因子であるfactor XIIIa (FXIIIa)に対する抗体を含めこれまで種々の抗体が検討されている。しかし、その結果は諸家の間で必ずしも一致せず、鑑別の有用な補助マーカーとしての抗体が必要とされている。 また近年、腫瘍の悪性度の客観的な評価を目的として、種々の腫瘍の増殖率や核DNA量の異常(異数体;aneuploidy)が調べられている。その結果、一般に悪性腫瘍は良性腫瘍に比べて高い増殖率を示し、多くの良性腫瘍はdiploidyであるのに対し、悪性腫瘍ではしばしばaneupioidyが認められ、これらの結果は腫瘍の悪性度や予後と密接に関係することが報告されている。またp53蛋白の免疫学的過剰発現も種々の腫瘍において悪性度や予後と相関することが報告されている。 本研究の目的の一つはDFSPとDF、FS及びMFHについて免疫組織化学的な検討を主体として組織学的及び電子顕微鏡的にその鑑別点を明らかにすることである。免疫組織化学的な検討に際し、既存の抗体について改めて多くの症例でその発現を調べ、諸家の報告と比較検討することにより鑑別に有用な補助マーカーとなりうる抗体を検索した。また今回の検討では同一腫瘍における組織像の違いによる染色結果の影響にも着目した。もう一つの目的はDFSPを中心にこれら腫瘍の増殖率、核DNA量及びp53蛋白の過剰発現を調べ、腫瘍の生物学的悪性度との関係を詳細に検討することである。つまりこれらの指標により悪性度の定量的な評価が可能であるか否か、DFSPがこれらの客観的な指標の上からも中間悪性度の腫瘍に位置づけられるか否か、そしてDFSP-FSの悪性度を客観的に評価することである。 材料はDFSP19症例23腫瘍(DFSP-FS3症例3腫瘍)、DF46症例46腫瘍、FS4症例9腫瘍、MFH11症例14腫瘍であり、ホルマリン固定後バラフィン包埋された生検及び手術検体を用いた。DFに関しては腫瘍を構成する細胞の形態が線維芽細胞様細胞か組織球様細胞かによりspindle cell type 27例、histiocytic cell type10例及びmixed cell type9例に分類した。鑑別を目的としてCD34、FXIIIa、中間径フィラメントであるvimentinとアクチンのマーカーであるHHF-35(muscle specific actin)及び1A-4(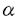 -smooth muscle actin)、組織球系マーカーであるKP-1、MAC387及びlysozyme、神経外胚葉性マーカーであるS-100蛋白に対する抗体を用いた。悪性度の評価においては抗MIB-1及び抗PCNA(prolifer ative cell nuclear antigen)抗体を用いて増殖率を調べ、p53蛋白の過剰発現を免疫組織化学的に検討し、核DNA量の異常をフローサイトメトリーを用いて検索した。悪性度の評価に際しDFSPをDFSP-FSとFS-areaを含まないふつうのDFSP(DFSP-FS(-))、そしてDFSP-FS(-)における原発及び再発腫瘍に分け比較検討し、悪性度の正確な評価を行うため腫瘍内のheterogeneityを考慮して多くの部分より測定を行った。 -smooth muscle actin)、組織球系マーカーであるKP-1、MAC387及びlysozyme、神経外胚葉性マーカーであるS-100蛋白に対する抗体を用いた。悪性度の評価においては抗MIB-1及び抗PCNA(prolifer ative cell nuclear antigen)抗体を用いて増殖率を調べ、p53蛋白の過剰発現を免疫組織化学的に検討し、核DNA量の異常をフローサイトメトリーを用いて検索した。悪性度の評価に際しDFSPをDFSP-FSとFS-areaを含まないふつうのDFSP(DFSP-FS(-))、そしてDFSP-FS(-)における原発及び再発腫瘍に分け比較検討し、悪性度の正確な評価を行うため腫瘍内のheterogeneityを考慮して多くの部分より測定を行った。 免疫染色の結果、CD34はDFSPの96%に陽性、DF、FS及びMFHのほとんどの症例で陰性であった。しかしCD34の染色態度はDESPの組織パターンで異なり粘液腫状部分やFS-areaで陰性を示す一方、FSやMFHのstoriform patternに弱陽性が認められた。FXlllaはDFSP、FS及びMFHのすべてに陰性、DFの82%に陽性であった。抗アクチン抗体(HHF-35、1A-4)及びKP-1に対してはDESP、FS及びMFHはほとんど陰性であったのに対し、DF spindle cell typeではHHF-35が94%、1A-4が57%にびまん性あるいは限局性に陽性を示し、KP-1はhistiocytic cell typeの90%に弱陽性の所見が認められた。電顕的観察ではDFSPの腫瘍細胞は特徴的所見に乏しく、細胞内小器官が著明に発達しているFSやMFHの紡錘形腫瘍細胞に比べて小器官の発達は乏しく未分化間葉系細胞に類似する細胞像であった。 増殖率の解析において、MIB-1とPCNAの結果に相関が認められ、DFSPの平均MIB-1 labeling index(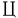 )(10.5±7.7%,1.4-25.8%)は良性腫瘍のDF(3.6±1.8%,0.8-8.3%)と悪性腫瘍であるFS(17.0±5.6%,9.8-30.7%)及びMFH(23±7.2%,12-33.7%)の中間の値を示した。DFSP-FSの )(10.5±7.7%,1.4-25.8%)は良性腫瘍のDF(3.6±1.8%,0.8-8.3%)と悪性腫瘍であるFS(17.0±5.6%,9.8-30.7%)及びMFH(23±7.2%,12-33.7%)の中間の値を示した。DFSP-FSの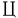 (21.5±5.1%,12-23.3%)はDFSP-FS(-)の (21.5±5.1%,12-23.3%)はDFSP-FS(-)の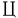 (8.6±6.7%,0.8-25.8%)に比べてより高く、FSの (8.6±6.7%,0.8-25.8%)に比べてより高く、FSの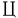 と類似していた。しかしDFSP-FS(-)においても、その再発腫瘍の と類似していた。しかしDFSP-FS(-)においても、その再発腫瘍の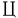 (11.3±6.4%,2.7-25.8%)は原発腫瘍(3.0±1.7%,1.4-5.6%)に比べ有意に高く、頻回に再発する腫瘍では悪性腫瘍のFSやMFHに匹敵するほどの高い増殖率が認められた。一方、DFSP-FS(-)の原発腫瘍とDFの (11.3±6.4%,2.7-25.8%)は原発腫瘍(3.0±1.7%,1.4-5.6%)に比べ有意に高く、頻回に再発する腫瘍では悪性腫瘍のFSやMFHに匹敵するほどの高い増殖率が認められた。一方、DFSP-FS(-)の原発腫瘍とDFの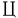 は同程度であった。核DNA量の測定では、DFはすべてdiploidyであるのに対し、aneuploidyはDFSPでは26%に、FS及びMFHではすべての症例に認められた。またaneuploid DFSPの80%が再発腫瘍であり、FSやMFHのほとんどの腫瘍が種々のDNA index(Dl)を示すhyper diploidyやmultiploidyであるのに対し、DFSPではいずれの症例もほぼ同じD1のnear-diploidyを示していた。p53蛋白の過剰発現はDFSPの16%の症例にみられたが陽性細胞は極く少数(0<<2%)であった。DFはすべての症例で陰性、FSは75%の症例に5%までの陽性細胞を認め、MFHでは90%の症例が陽性で、そのうち44%に高度の発現(70%)が認められた。また増殖率、核DNA量及びp53蛋白の過剰発現の各々の結果の間に密接な関係が認められ、今回検索した腫瘍においてaneuploidyを示す腫瘍やp53蛋白の過剰発現を示す腫瘍の増殖率はdiploidyやpS3蛋白陰性の腫瘍に比べ有意に高く、p53蛋白の過剰発現はdiploidyよりaneuploidyを示す腫瘍において高頻度に認められた。本研究の結果、DFSPの腫瘍細胞は免疫染色の結果と同様に電顕的にも特徴的な所見に乏しく、その起源として未分化な間葉系の細胞が示唆された。そしてDFSPとその関連する腫瘍の免疫組織化学的な鑑別にはこれまでの報告と同様、CD34及びFXIIIaが有用なマーカーであることが確かめられた。しかしCD34やFXIIIaは特異性を欠き、より正確な診断のために抗アクチン抗体及びKP-1を加えることが必要であると考えられた。増殖率、核DNA量及びp53蛋白の過剰発現は腫瘍の生物学的悪性度と密接に関係し、腫瘍の悪性度を客観的に評価しうることが確かめられた。ただ悪性度の正確な評価を行なうためには腫瘍内のheter ogenietyを考慮してサンプリングすることが重要であり、これらの複数の指標を用いて腫瘍の悪性度を客観的に評価することにより、DFSPとその関連する腫瘍における良悪の鑑別や治療効果及び予後の推測に役立つ可能性が示唆された。そしてDFSPが臨床的だけでなく客観的にも中間悪性度の腫瘍に位置づけられ、またDFSP-FSの悪性度が高いことが明らかになった。そしてDFSPの再発腫瘍は原発腫瘍に比べより高い増殖率を示し、aneuploidyが再発腫瘍に多く見られたことは、DFSPにおいて繰り返す再発は悪性度の亢進、つまりプログレッションを意味していると考えられた。 は同程度であった。核DNA量の測定では、DFはすべてdiploidyであるのに対し、aneuploidyはDFSPでは26%に、FS及びMFHではすべての症例に認められた。またaneuploid DFSPの80%が再発腫瘍であり、FSやMFHのほとんどの腫瘍が種々のDNA index(Dl)を示すhyper diploidyやmultiploidyであるのに対し、DFSPではいずれの症例もほぼ同じD1のnear-diploidyを示していた。p53蛋白の過剰発現はDFSPの16%の症例にみられたが陽性細胞は極く少数(0<<2%)であった。DFはすべての症例で陰性、FSは75%の症例に5%までの陽性細胞を認め、MFHでは90%の症例が陽性で、そのうち44%に高度の発現(70%)が認められた。また増殖率、核DNA量及びp53蛋白の過剰発現の各々の結果の間に密接な関係が認められ、今回検索した腫瘍においてaneuploidyを示す腫瘍やp53蛋白の過剰発現を示す腫瘍の増殖率はdiploidyやpS3蛋白陰性の腫瘍に比べ有意に高く、p53蛋白の過剰発現はdiploidyよりaneuploidyを示す腫瘍において高頻度に認められた。本研究の結果、DFSPの腫瘍細胞は免疫染色の結果と同様に電顕的にも特徴的な所見に乏しく、その起源として未分化な間葉系の細胞が示唆された。そしてDFSPとその関連する腫瘍の免疫組織化学的な鑑別にはこれまでの報告と同様、CD34及びFXIIIaが有用なマーカーであることが確かめられた。しかしCD34やFXIIIaは特異性を欠き、より正確な診断のために抗アクチン抗体及びKP-1を加えることが必要であると考えられた。増殖率、核DNA量及びp53蛋白の過剰発現は腫瘍の生物学的悪性度と密接に関係し、腫瘍の悪性度を客観的に評価しうることが確かめられた。ただ悪性度の正確な評価を行なうためには腫瘍内のheter ogenietyを考慮してサンプリングすることが重要であり、これらの複数の指標を用いて腫瘍の悪性度を客観的に評価することにより、DFSPとその関連する腫瘍における良悪の鑑別や治療効果及び予後の推測に役立つ可能性が示唆された。そしてDFSPが臨床的だけでなく客観的にも中間悪性度の腫瘍に位置づけられ、またDFSP-FSの悪性度が高いことが明らかになった。そしてDFSPの再発腫瘍は原発腫瘍に比べより高い増殖率を示し、aneuploidyが再発腫瘍に多く見られたことは、DFSPにおいて繰り返す再発は悪性度の亢進、つまりプログレッションを意味していると考えられた。 |