| 研究目的、研究の背景 歯状核赤核淡蒼球ルイ体萎縮症(Dentatorubral-pallidoluysian atrophy,以下DRPLA)は、常染色体優性遺伝形式を示す進行性神経変性疾患で、その主病変は、小脳歯状核赤核系及び淡蒼球ルイ体系に存在する。DRPLAは、責任遺伝子内でポリグルタミン鎖をコードするCAG3塩基反復配列が、異常に伸張することによって起こる。160kDaのDRPLA蛋白をコードするこの遺伝子は広く組織で発現し、mRNA及び蛋白発現レベルは、3塩基反復配列の伸張によって影響を受けない。 CAG伸張はDRPLA以外に、ハンチントン病を含む7つの遺伝性神経変性疾患でも認められる。最近の研究から、CAG伸張病に共通な細胞死の原因として、伸張ポリグルタミン鎖が凝集体を形成し細胞死を引き起こすという、いわゆるgain of function説が提唱されている。しかしこの仮説だけでは、脳責任病巣の疾患特異性を説明できない。CAG伸張病責任遺伝子はどれも組織に広く発現しているにも関わらず、神経細胞脱落は疾患毎に特異な領域で起こる。疾患遺伝子産物と結合し、協同して働く蛋白の存在が、病因解明に重要であると考えられる。また、責任遺伝子産物の正常機能については、SBMAがアンドロジェンレセプター、SCA6がカルシウムチャンネルサブユニットであると判明している以外、DRPLAを含む他の6疾患では不明のままである。責任遺伝子産物と結合する蛋白の同定は、これらの正常機能を探る上でも重要な手がかりとなる。 この論文で私は、DRPLA蛋白がインスリン受容体チロシンキナーゼ基質と特異的に結合することを述べる。イースト ツーハイブリッド法を用いて、DRPLA結合蛋白をスクリーニングした結果、53kDaインスリン受容体基質(IRSp53)ヒトホモログを同定した。さらにDRPLA蛋白との結合部位をin vitro,in vivoで明らかにし、ポリグルタミン鎖伸張による結合への影響を検討した。 研究方法、研究結果 イースト ツーハイブリッド法には、DRPLA蛋白C-末側3/4をいわゆる"餌"とし、相当するDRPLA cDNAをベクターpAS2-1の GAL4 DNA binding domain(BD)下流に挿入して用いた。まず、このプラズミドでイーストを形質転換し、続けてヒト胎児脳cDNAライブラリーをGAL4 activation domain(AD)下流に持つpACT2ベクターを導入して、1.2x107コロニーをスクリーニングした。レポーター遺伝子には、ヒスチジン自家栄養性(HIS3)と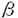 -ガラクトシダーゼ(LacZ)を用いた。BDに続くDRPLA蛋白にAD融合蛋白が結合し、二つのレポーター遺伝子が共に活性化されているコロニーを陽性とした。その結果30の陽性クローンを得た。 -ガラクトシダーゼ(LacZ)を用いた。BDに続くDRPLA蛋白にAD融合蛋白が結合し、二つのレポーター遺伝子が共に活性化されているコロニーを陽性とした。その結果30の陽性クローンを得た。 このうち互いに重複した7クローンから、チャイニーズハムスターIRSp53に相同な、ヒトIRSp53 cDNAの全アミノ酸翻訳領域を含む塩基配列が得られた。ヒトIRSp53には、1-1656塩基まで共通で3’側の違いにより、longer form(IRSp53L)とshorter form(IRSp53S)のスプライスバリアントが存在することが分かった。ヒト成人組織を用いたノーザンブロットでは、IRSp53Lは主に脳に、IRSp53Sは広く組織に発現していた。IRSp53Lは552アミノ酸を、IRSp53Sは521アミノ酸をコードした。511アミノ酸までの共通部分は、N-末側に3つのリン酸化可能なチロシンを、C-末側にSH3ドメインを持っていた。 IRSp53LのC-末側1/2に対するポリクローナル抗体を作製し、ウエスタンブロットを行った。この抗体は褐色細胞腫由来PC12細胞で、58kDa及び53kDaのラットIRSp53を特異的に認識した。PC12細胞をインスリンまたはIGF-1で刺激し、その細胞可溶分画を抗IRSp53抗体で免疫沈降後、抗リン酸化チロシン抗体でウエスタンブロットを行い、内因性IRSp53が、インスリン/IGF-1刺激によりリン酸化されることを確認した。これらのウエスタンブロット及び免疫沈降の結果は、先にクローニングされたハムスターIRSp53の結果と良く一致した。HeLa細胞に強発現したヒトIRSp53のインスリンによるリン酸化も確認した。 培養細胞内でのDRPLA蛋白とIRSp53の結合を、免疫沈降法で確認した。HeLa細胞に強発現したIRSp53Lは、抗DRPLA抗体によりDRPLA蛋白と共沈した。PC12細胞可溶分画を抗IRSp53抗体で免疫沈降し、共に内因性のDRPLA蛋白とIRSp53とが共沈する事を、抗DRPLA抗体を用いたウエスタンブロットで確認した。インスリン刺激の有無で、IRSp53と沈降するDRPLA蛋白量に著明な変化を認めなかった。次に細胞内での共存を、共焦点レーザー蛍光顕微鏡で観察した。細胞質内でのDRPLA蛋白の局在を明らかにするため、核移行シグナルを除いたDRPLA蛋白をHeLa細胞に強発現した。ポリグルタミン鎖の長さに関わらず、この一部は核周囲領域で内因性IRSp53と共存することが確認された。伸張ポリグルタミン鎖を持つDRPLA蛋白が作る核内凝集体に、IRSp53が巻き込まれることはなかった。 イーストにBD-DRPLAとAD-IRSp53を共に発現して、DRPLA蛋白とIRSp53の結合特異性を再確認した。次にDRPLA cDNAのC-末側3/4をさらに3分割し、各々をBD cDNA下流に挿入し、pACT2/IRSp53とのイーストツーハイブリッドを行った結果、DRPLA蛋白のポリグルタミン鎖近傍335-786アミノ酸に、IRSp53との結合部位が存在するがわかった。さらにこの部位に相当する伸張ポリグルタミン鎖を持つDRPLA cDNAを用いてツーハイブリッドを行い、結合の強さを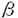 -ガラクトシダーゼ活性で定量し、正常DRPLAと比較した。ポリグルタミン鎖伸張によりIRSp53との結合が1/3程度に弱められることが分かった。 -ガラクトシダーゼ活性で定量し、正常DRPLAと比較した。ポリグルタミン鎖伸張によりIRSp53との結合が1/3程度に弱められることが分かった。 DRPLA蛋白とIRSp53との結合部位をさらに詳しく知るため、in vitroで結合部位を同定した。IRSp53全長、C-末側1/2、及びN-末側1/2とGSTとの融合蛋白をグルタチオンセファロースに吸着してカラムを作り、DRPLA in vitro翻訳産物との結合を調べた。DRPLA蛋白はポリグルタミン鎖長に関わらず、全長及びC-末側1/2のIRSp3と結合し、N-末側とは結合しなかった。IRSp53C-末側1/2にはSH3ドメインが存在し、ここがDRPLA蛋白との結合部位と考えられた。さらにDRPLAのC-末からの欠失変異体をin vitro翻訳で作り、IRSp53C-末側1/2との結合を調べた。517-567アミノ酸を欠失するとカラムに結合しなくなることから、この部位が結合に必須であると分かった。この部位にはSH3ドメインと結合するプロリン-リッチ領域のコンセンサスアミノ酸配列が一つ存在し、これがIRSp53との結合のコアシークエンスと考えられた。伸張ポリグルタミン鎖DRPLAは、正常DRPLA蛋白の1-696アミノ酸に相当する部分は結合を保っていたが、598アミノ酸まで欠失すると、コアシークエンスを含んでいるにも関わらず、IRSp53への結合が著明に弱められた。ポリグルタミン鎖伸張によりさらに599-696アミノ酸も結合を保つのに必要になることが分かった。 考察とまとめ IRSp53は1996年にハムスターでクローニングされ、インスリン/IGF-1刺激により、脳でリン酸化されることが確認されている。さらに本論文で示したように、ヒトではスプライシングの違いにより、広く組織に発現するshorter formと、脳に特異的なlonger formが存在した。IRSp53の翻訳後修飾、組織特異的リン酸化と、シグナル伝達における働きについて、今後さらに検討が必要と考える。 SH3ドメインを介した結合は、シグナル伝達に関与する蛋白複合体内でよく見られる。SH3ドメインに結合するプロリン-リッチ領域は、PXXPX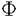 、または 、または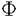 XXPXXP( XXPXXP(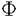 は塩基性アミノ酸)のアミノ酸で構成され、PP IIヘリックス構造をとる。本論文では、DRPLA蛋白のポリグルタミン鎖近傍にあるプロリン-リッチ領域が、ヒトIRSp53のSH3ドメインに結合することを示した。伸張ポリグルタミン鎖を持つDRPLA蛋白は、本論文のin vivo分析の結果から推測すると、神経細胞内でもIRSp53と結合を保っていると考えられた。しかし結合部位は正常とは異なり、この変化がDRPLA蛋白を含むシグナル伝達複合体の構造に影響を及ぼし、細胞機能障害を起こす可能性が考えられた。 は塩基性アミノ酸)のアミノ酸で構成され、PP IIヘリックス構造をとる。本論文では、DRPLA蛋白のポリグルタミン鎖近傍にあるプロリン-リッチ領域が、ヒトIRSp53のSH3ドメインに結合することを示した。伸張ポリグルタミン鎖を持つDRPLA蛋白は、本論文のin vivo分析の結果から推測すると、神経細胞内でもIRSp53と結合を保っていると考えられた。しかし結合部位は正常とは異なり、この変化がDRPLA蛋白を含むシグナル伝達複合体の構造に影響を及ぼし、細胞機能障害を起こす可能性が考えられた。 IGF-1は脳における栄養因子、または抗アポトーシス因子として知られており、脳でのIGF-1シグナル伝達を解明する上でも、興味深い結果が得られた。我々がスクリーニングしたDRPLA結合蛋白の中には、ほかにもいくつかシグナル伝達関連蛋白が含まれている。現在それらの蛋白も含めて、DRPLA蛋白の機能について検討している。 |