| 内容要旨 | | 序論 血小板活性化因子(platelet-activating factor;PAF;1-O-alkyl-2-sn-glycero-3-phosphocholine)はエーテル型リン脂質構造を持つ化学伝達物質で、全身で多彩な生物活性を示す。PAFは細胞膜上の特異的なPAF受容体に結合しその生理機能を発揮する。1991年にモルモット肺からPAF受容体のcDNAがクローニングされ、その後ヒト・ラット・マウスからもcDNAあるいはゲノムDNAのクローニングが相次いだ。さらに、PAF受容体は血小板・好中球・単球・好酸球・リンパ球・血管内皮細胞・平滑筋細胞・ニューロン・ミクログリアにも存在することが明らかになり、in vivo、in vitroの両面から、PAFとPAF受容体の関与した生物学的現象のメカニズムが解明されつつある。 皮膚疾患におけるPAFの役割については、寒冷蕁麻疹や乾癬などのアレルギー性及び炎症性皮膚疾患への関与が注目されてきた。1995年、Traversらは培養ヒトケラチノサイトにPAF受容体が存在することを蛍光抗体法で明らかにし、PAFに対する細胞内カルシウムイオンの反応や、結合実験により、PAF受容体が機能していることを明らかにした(Travers et al.,1995)。また、1998年、Shimadaらは我々との共同研究でヒト培養ケラチノサイトにPAF受容体mRNAが存在することを明らかにした(Shimada et al.,1998)。 1997年、当教室の石井らがPAFとPAF受容体のin vivoでの生理学的役割を解明するため、PAF受容体トランスジェニックマウスの樹立と表現形解析を行った(Ishii et al.,1997)。導入遺伝子はchicken 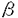 -actinプロモーターとCMV immediate early enhancerの制御下に、モルモットPAF受容体cDNAを組み込んだものであった。これをBDF1マウスの受精卵の前核に微小注入してトランスジェニックマウスを作製した。このマウスはメサコリンに対する気道の過敏性や、細菌エンドトキシンによる致死率の増加の他、皮膚の形態変化を示し、成長とともに表皮の肥厚と褐色斑の増強が認められた。褐色斑は組織学的解析より、真皮メラノサイトの増加とメラニン産生の亢進によることが確認された。以上のような背景をもとに、PAF受容体トランスジェニックマウスにおける皮膚形態の異常の機構を解明し、さらにPAFの皮膚における役割を解明する目的で次のような研究を行った。 -actinプロモーターとCMV immediate early enhancerの制御下に、モルモットPAF受容体cDNAを組み込んだものであった。これをBDF1マウスの受精卵の前核に微小注入してトランスジェニックマウスを作製した。このマウスはメサコリンに対する気道の過敏性や、細菌エンドトキシンによる致死率の増加の他、皮膚の形態変化を示し、成長とともに表皮の肥厚と褐色斑の増強が認められた。褐色斑は組織学的解析より、真皮メラノサイトの増加とメラニン産生の亢進によることが確認された。以上のような背景をもとに、PAF受容体トランスジェニックマウスにおける皮膚形態の異常の機構を解明し、さらにPAFの皮膚における役割を解明する目的で次のような研究を行った。 1.PAF受容体トランスジェニックマウスの成長に伴う表皮の肥厚と真皮メラノサイトの増加を、経時的に肉眼的および組織学的に観察した。 2.皮膚における導入遺伝子の発現部位をin situ hybridizationで明らかにした。 3.導入遺伝子の発現した表皮ケラチノサイトの増殖と分化の性質を核酸の取り込みや分化マーカーを用いて解析し、表皮の肥厚の機序を明らかにした。 4.PAF受容体拮抗薬含有クリームを塗布し、表皮ケラチノサイトの増殖と分化に対する影響を観察し、皮膚症状がPAF及びPAF受容体に関連することを直接に明らかにした。 方法と結果 雄PAF受容体トランスジェニックマウスと雌BDF1野生型マウスを交配し、出生したマウスを実験に使用した。各マウスの遺伝子型はPCR法により導入遺伝子DNAの有無を検出することにより決定した。 成長に伴う皮膚の形態変化を肉眼的及び組織学的に調べた。2週齢毎にマウスの右側の耳と尾を撮影し、肉眼的な観察を行った。左耳は、一部を採皮してhematoxylin-eosin染色、Fontana-Masson染色を行い組織学的な観察に用いた。肉眼的には、4週齢からトランスジェニックマウスの耳と尾の皮膚に褐色斑が観察され始め、色調は6週齢前後からコントロールマウスよりも濃くなった。体毛と目の色には変化はなかった。組織学的に、PAF受容体トランスジェニックマウスでは、耳の皮膚は2週齢からすでに表皮が肥厚していた。この症状は加齢とともに進行し、14週齢ではコントロールマウスの3倍の厚さになり表皮ケラチノサイトは5から6層に達していた。尾や背測の皮膚でも同様の傾向が見られた。真皮メラノサイトの数はコントロールマウスで約350個/mm2で終生一定していたが、PAF受容体トランスジェニッマウスにおいては個体差はあるものの週齢とともに増加し14週齢では約570個/mm2であった。 次に、皮膚における導入遺伝子の発現をみるため、in situ hybridization(ISH)を行った。13週齢のマウスと46週齢で耳にメラノサイト腫瘍を形成したマウスを用いた。プローブは、モルモットPAF受容体の翻訳領域内のNcoI-AccIフラグメント(224bp)を用いて作製し、digoxigenin-11-UTPで標識した。また、真皮メラノサイトでの発現の有無を確認するために過酸化水素処理でメラニン色素を脱色処理した後にもISHを行った。その結果、導入遺伝子は表皮ケラチノサイトに強く発現していることが明らかになった。また、一部の真皮メラノサイトにも弱いシグナルが認められた。 そこで、トランスジェニックマウスの肥厚した表皮の性質を調べるため、導入遺伝子が強く発現した表皮ケラチノサイトの増殖と分化を観察した。増殖能の実験は5-bromo-2’-deoxyuridine(BrdU)溶液を13週齢マウスに腹腔内注射し(3mg/100g体重)、2時間後採皮し、BrdU陽性細胞を免疫染色で検出した。トランスジェニックマウスの表皮ケラチノサイトにおいては、BrdU陽性細胞数はコントロールマウスと同様に基底層に検出されたが、100個の基底細胞数あたりの陽性細胞数は背側の耳で6.34±1.14(mean±SD,n=3)とコントロールマウスの1.83±0.61(n=4)に比べ有意に増加していた。 表皮ケラチノサイトの分化の程度は、表皮の分化マーカーである抗マウスK1抗体、抗マウスK10/K11抗体、抗マウスフィラグリン抗体を用いて13週齢のマウスの耳と背側の皮膚を免疫染色することにより解析した。その結果、トランスジェニックマウスとコントロールマウスの双方ともにK1とK10/K11は有棘層に、フィラグリンは顆粒層に認められた。以上の結果より、トランスジェニックマウスの表皮は、増殖が亢進しているが、分化は正常に保たれていることが明らかになった。 次に、表皮ケラチノサイトの増殖に対するPAFの関与を明らかにするため、PAF受容体拮抗薬であるWEB2086クリームの塗布実験を行い、BrdU陽性細胞数が抑制されるかどうかを調べた。7週齢のマウスの左側の耳と背側皮膚に1回につき120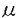 gのWEB2086含有クリームを、右側にプラセボクリームを同様に1日1回、7日間塗布した後、採皮し、さきに述べた増殖能のアッセイと分化マーカーを用いた免疫染色を行った。その結果、トランスジェニックマウスの背側の耳の表皮ケラチノサイトで、WEB2086含有クリーム塗布側のBrdU陽性細胞数は2.00±1.12(n=4)、プラセボクリーム塗布側は6.34±1.13(n=4)と有意にBrdU陽性細胞が減少した。同様の傾向はコントロールマウスにも認められた。なお、分化マーカーの発現には変化はみられなかった。以上よりPAFが表皮ケラチノサイトの増殖に関与している可能性が示された。 gのWEB2086含有クリームを、右側にプラセボクリームを同様に1日1回、7日間塗布した後、採皮し、さきに述べた増殖能のアッセイと分化マーカーを用いた免疫染色を行った。その結果、トランスジェニックマウスの背側の耳の表皮ケラチノサイトで、WEB2086含有クリーム塗布側のBrdU陽性細胞数は2.00±1.12(n=4)、プラセボクリーム塗布側は6.34±1.13(n=4)と有意にBrdU陽性細胞が減少した。同様の傾向はコントロールマウスにも認められた。なお、分化マーカーの発現には変化はみられなかった。以上よりPAFが表皮ケラチノサイトの増殖に関与している可能性が示された。 考察 本論文ではPAF受容体トランスジェニックマウスで見られた皮膚の異常について解析した。トランスジェニックマウスでは週齢とともに皮膚の厚さが増し、真皮メラノサイトの数が増加した。次に皮膚における導入遺伝子が表皮ケラチノサイトに局在することをISHで示した。その結果に基づいて表皮ケラチノサイトの増殖と分化について調べ、トランスジェニックマウスの表皮ケラチノサイトの特性を明らかにした。さらに、PAF受容体拮抗薬含有クリームの塗布実験により表皮ケラチノサイトの増殖に対するPAFの関与を明らかにした。 細胞の増殖は、細胞周期のS期にDNA中にBrdUがとりこまれることを利用して調べることができ、BrdU陽性細胞は増殖の程度をおおむね反映する。トランスジェニックマウスでは、BrdU陽性細胞は基底層にのみ認められ、その数はコントロールマウスよりも増加していた。つまり、トランスジェニックマウスでは基底層における表皮ケラチノサイトの増殖が亢進していることが明らかになった。一方、表皮の分化については、特異的なマーカーを使って免疫染色で調べることができ、サイトケラチンK1は成熟した表皮が分化する際早期に発現するマーカー、K10/K11は有棘層のケラテノサイトのマーカー、フィラグリンは表皮の顆粒層に発現する分化後期のマーカーである。トランスジェニックマウスとコントロールマウスの双方とも有棘層にK1とK10/K11を、顆粒層にフィラグリンを発現していた。これらの所見より、トランスジェニックマウスの表皮ケラチノサイトは正常な分化を示しながらも増殖が亢進した結果、表皮の肥厚を生じたと考えられた。 また、PAF受容体拮抗薬含有クリームの塗布実験では、トランスジェニックマウスで、BrdU陽性細胞数はプラセボのクリームを塗布した皮膚よりも著明に減少した。この結果から、PAFはin vivoで表皮ケラチノサイトの増殖を助長する役割を持っており、トランスジェニックマウスではPAF受容体の過剰発現がケラチノサイトの過形成をきたしたものと考えられた。 一方、PAF受容体トランスジェニックマウスでは真皮メラノサイトも増加し、40週齢以上のマウスにメラノサイト系の腫瘍を生じる個体もあった(Ishii et al.,1997)。今回行ったISHでは真皮メラノサイトには弱いシグナルを認めたが、発現量は表皮ケラチノサイトよりも少ないと考えられた。従って、メラノサイトの増殖に関しては、長期間微量のPAFがPAF受容体に作用したのみでなく、増殖した表皮ケラチノサイトが何らかの増殖因子(stem cell factor、basic fibroblast growth factor、endothelin-1等)を産生し、これが二次的に働く可能性も考えられた。皮膚におけるPAFの産生のメカニズムやPAF受容体刺激がケラチノサイトやメラノサイトの増殖に至る分子機構は今後の課題であるが、PAF受容体トランスジェニックマウスは乾癬や母斑などのモデル動物になりうることが示された。 参考論文Sato S,Kume K,Ito C,Ishii S and Shimizu T(1999):Accelerated proliferation of the epidermal keratinocytes by the transgenic expression of the platelet-activating factor receptor.Archives of Dermatological Research,vol 291(11),page 614-621Ishii S,Nagase T,Tashiro F,Ikuta K,Sato S,Waga I,Kume K,Miyazaki J and Shimizu T(1997):Bronchial hyperreactivity,increased endotoxin lethality and melanocytic tumorigenesis in transgenic mice overexpressing platelet-activating factor receptor.EMBO J.16,133-142Shimada A,Ota Y,Sugiyama Y,Sato S,Kume K,Shimizu T and Inoue S(1998):In situ expression of platelet-activation factor(PAF)-receptor gene in rat skin and effects of PAF on proliferation and differentiation of cultured human keratinocytes.J.Invest.Dermatol.110,889-893Travers JB,Huff JC,Rola PM,Gelfand EW,Morelli JG and Murphy RC(1995):Identification of functional platelet-activating factor receptors on human keratinocytes.J.Invest.Dermatol.105,816-823 |
| 審査要旨 | | 血小板活性化因子(platelet-activating factor;PAF;1-O-alkyl-2-sn-glycero-3-phosphocholine)はエーテル型リン脂質構造を持つ化学伝達物質で,全身で多彩な生物活性を示す。皮膚では,アレルギー性及び炎症性皮膚疾患への関与が注目されたことに始まり,近年ヒト培養ケラチノサイトにPAF受容体が存在し,機能していることが明らかになったが,その生理的役割はまだ不明である。本研究は,PAF受容体を過剰発現したPAF受容体トランスジェニックマウスで,成長とともに表皮の肥厚と真皮メラノサイトの増加が確認されたことから,この形態異常を観察し,導入遺伝子の発現を明らかにしたうえで表皮ケラチノサイトの増殖と分化についてその性質を調べ,表皮ケラチノサイトの増殖におけるPAFの関与を検討したものである。その結果,以下のことが判明した。 1)PAF受容体トランスジェニックマウスの成長に伴う表皮の肥厚と真皮メラノサイトの増加を,経時的に肉眼的および組織学的に観察し,定量的に示した。肉眼的には,4週齢からトランスジェニックマウスの耳と尾の皮膚に褐色斑が観察され始め,色調は6週齢前後からコントロールマウスよりも濃くなった。体毛と目の色には変化はなかった。組織学的に,PAF受容体トランスジェニックマウスでは,耳の皮膚は2週齢からすでに表皮が肥厚していた。この症状は加齢とともに進行し,14週齢ではコントロールマウスの3倍の厚さになり表皮ケラチノサイトは5から6層に達していた。真皮メラノサイトの数はコントロールマウスで終生一定していたが,PAF受容体トランスジェニックマウスでは週齢とともに増加した。 2)皮膚における導入遺伝子の発現部位を明らかにするため,in situ hybridizationを行ったところ,導入遺伝子は表皮ケラチノサイトに強く発現していることが明らかになった。また,一部の真皮メラノサイトにも弱いシグナルが認められた。 3)トランスジェニックマウスの肥厚した表皮の性質を調べるため,導入遺伝子の発現した表皮ケラチノサイトの増殖の性質を5-bromo-2’-deoxyuridine(BrdU)の取り込みを用いて解析した。PAF受容体トランスジェニックマウスの表皮ケラチノサイトにおけるBrdU腸性細胞数はコントロールマウスよりも増加しており,表皮の肥厚は増殖の亢進によるものと考えられた。 4)PAF受容体トランスジェニックマウスの表皮ケラチノサイトにおける分化の性質を明らかにするため,分化マーカーのK1,K10/K11,フイラグリンの発現を免疫組織学的に調べた結果,トランスジェニックマウスとコントロールマウスの双方ともにK1とK10/K11は有棘層に,フィラグリンは顆粒層に認められた。以上の結果より,トランスジェニックマウスの表皮は,増殖が亢進しているが,分化は正常に保たれていることが明らかになった。 5)表皮ケラチノサイトの増殖に対するPAFの関与を明らかにするため,PAF受容体拮抗薬含有クリームを塗布し,表皮ケラチノサイトの増殖と分化に対する影響を観察した。その結果,トランスジェニックマウスの表皮ケラチノサイトで,PAF受容体拮抗薬含有クリーム塗布側のBrdU陽性細胞数はプラセボクリーム塗布側と比較すると,有意に減少した。また,分化マーカーの発現に変化はなかったことから,PAFは表皮ケラチノサイトの増殖に関与しているが,分化には影響を与えないことが示唆された。 以上,本論文はPAF受容体トランスジェニックマウスの皮膚の形態異常を解析することにより,PAFがin vivoで表皮ケラチノサイトの増殖を助長する役割を持っていることを明らかにした。これは,今後の皮膚におけるPAFの生理的役割や皮膚疾患におけるPAFの役割の解明に貢献をなすと考えられ,学位の授与に値するものと考えられる。 |