緒言 Interleukin 12(IL-12)は、互いに相同性のないp40とp35のサブユニットからなる分子量約70kDのヘテロダイマーである。IL-12はヘルパーT(Th)細胞亜集団Th1/Th2のバランスを制御し、Th1の免疫反応を増強する活性を持つ所から、その産生制御の機構を研究することは重要なテーマであると考えられる。
IL-12産生にはT細胞依存的産生とT細胞非依存的産生とがある。T細胞依存的産生とは、Th1細胞と抗原提示細胞(APC)の相互反応によりAPCから産生されるもので、CD40-CD40L反応により産生が誘導されることが明らかになっている。一方、T細胞非依存的産生とは、T細胞との接触とは関係なく微生物感染や菌体成分、例えばLPS、などの刺激によりmacrophage(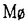 )等から産生されるものである。
)等から産生されるものである。
Th2細胞とAPCの相互反応においては、Th2細胞のCD40Lの発現がTh1細胞にくらべて非常に弱いとされており、CD40-CD40L反応が起こっているか否かは不明である。また、抗原刺激によりTh2細胞からIL-10が産生される。培養系にIL-10を加えるとLPS等の刺激によるIL-12産生は強く抑制されることが知られている。しかし、Th2によるIL-10産生が、Th2-APC相互反応によるIL-12産生に与える影響については明らかになっていない。そこで、Th2細胞とAPCの反応によってIL-12産生がおこるか否か、もしIL-12産生がないとすればIL-10の関与があるか否かを検討した。
前述のT細胞非依存的IL-12産生を誘導する刺激として代表的なLPS刺激においては、LPS刺激によるIL-12産生にはIFN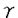 によるpriming(前培養)が必須であると考えられている。しかし、IFN
によるpriming(前培養)が必須であると考えられている。しかし、IFN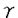 欠損マウス由来細胞のLPS刺激によるIL-12産生は野生型マウスと同じレベルであることが報告されており、IFN
欠損マウス由来細胞のLPS刺激によるIL-12産生は野生型マウスと同じレベルであることが報告されており、IFN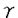 のprimingが必要であるとする考えと矛盾する。LPS刺激により
のprimingが必要であるとする考えと矛盾する。LPS刺激により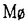 等がIL-10を産生することはすでに報告がある。従って、LPS刺激の場合にもIL-10がIL-12産生を抑制している可能性がある。そこで、まずIFN
等がIL-10を産生することはすでに報告がある。従って、LPS刺激の場合にもIL-10がIL-12産生を抑制している可能性がある。そこで、まずIFN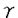 存在下での前培養がLPS刺激によるマウス脾細胞のIL-12産生に必要であるか否かを検討し、さらに、この系における
存在下での前培養がLPS刺激によるマウス脾細胞のIL-12産生に必要であるか否かを検討し、さらに、この系における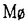 のIL-12産生に与えるIL-10の影響について検討した。IFN
のIL-12産生に与えるIL-10の影響について検討した。IFN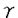 によるprimingの必要性についてはT細胞依存的なIL-12産生ついてもあわせて検討した。
によるprimingの必要性についてはT細胞依存的なIL-12産生ついてもあわせて検討した。
すなわち、この研究の目的は、Th-APC相互反応(T細胞非依存的)及びLPS刺激(T細胞依存的)によるIL-12産生における制御機構について、IL-12産生機構に関連して産生されるIL-10によるIL-12産生抑制効果ついて検討することである。
【結果と考察】Th1,Th2クローンをAPCを用いて抗原刺激する系において、培養上清中のIL-12活性を測定した。Th1クローンと共培養した脾細胞APC(ここではT細胞除去脾細胞を脾細胞APCとする)では6-12時間をピークとしてIL-12の産生がみられたが、Th2クローンを用いた場合には培養後24時間、いずれの時点でもIL-12の活性は検出されず(図1)、IL-12 p40のmRNAの発現増強もみられなかった。しかし、Th2クローンを用いる系に、抗IL-10を加えてIL-10の活性を抑制すると、抗IL-10の濃度依存的に培養上清中のIL-12活性が上昇した(図2)。
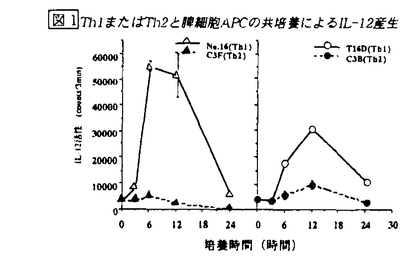 図1 Th1またはTh2と脾細胞APCの共培養によるIL-12産生
図1 Th1またはTh2と脾細胞APCの共培養によるIL-12産生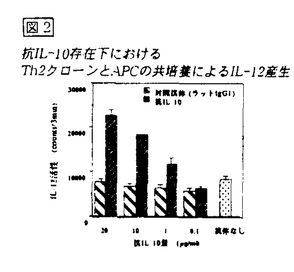 図2 抗IL-10存在下におけるTh2クローンとAPCの共培養によるIL-12産生
図2 抗IL-10存在下におけるTh2クローンとAPCの共培養によるIL-12産生 この所見はmRNA発現の検討によっても確認された。Th2クローンは抗原刺激によりIL-10を産生することが知られている。そこで、先ずTh2クローンを抗原刺激してIL-10産生の時間経過を検討した。刺激後わずか3時間で、Th1-APC相互反応によるIL-12産生を抑制するに十分量のIL-10が産生されることが分かった。Th1細胞とAPCの相互反応によるIL-12産生はCD40-CD40L反応によるものであることが,明らかになっている。そこで、抗IL-10存在下にTh2細胞とAPCの共培養で見られるIL-12産生も同じ分子間反応によるものであるかを検討した。まず、抗原刺激によってTh2細胞上にもTh1細胞と同じレベルのCD40Lが発現する事を確認した。さらに、抗IL-10存在下で見られるTh2-APC相互反応によるIL-12産生は抗CD40Lを加えることによってTh1-APC相互反応の場合と同様に完全に抑制された(図3)。すなわち、Th2細胞とAPCの相互反応においてもCD40-CD40L反応によってIL-12を産生し得るが、Th2によって産生されたIL-10がIL-12の産生を抑制することが明らかになった。
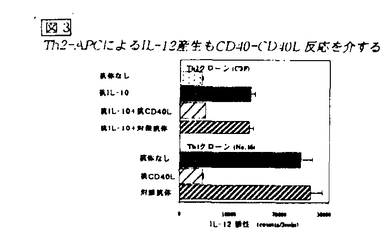 図3 Th2-APCによるIL-12産生もCD40-CD40L反応を介する
図3 Th2-APCによるIL-12産生もCD40-CD40L反応を介する 次にLPS刺激によるIL-12産生について、IFN によるprimingの必要性について検討を行った。先ず、CD40-CD40L反応によるIL-12産生におけるIFN
によるprimingの必要性について検討を行った。先ず、CD40-CD40L反応によるIL-12産生におけるIFN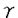 のprimingの効果について検討した。その結果、IFN
のprimingの効果について検討した。その結果、IFN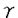 によるprimingはIL-12産生にはほとんど影響を及ぼさなかった。LPS刺激によるIL-12産生における影響について、採取してすぐの脾細胞(f-spleen cells)ではLPSのみの刺激ではIL-12を産生せず,LPSとIFN
によるprimingはIL-12産生にはほとんど影響を及ぼさなかった。LPS刺激によるIL-12産生における影響について、採取してすぐの脾細胞(f-spleen cells)ではLPSのみの刺激ではIL-12を産生せず,LPSとIFN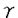 を同時に刺激を加えると微量のIL-12が産生された(図4)。一方、IFN
を同時に刺激を加えると微量のIL-12が産生された(図4)。一方、IFN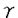 存在下又は非存在下に前培養した脾細胞(p-spleen cells)は,共にLPS刺激に応答して相当量のIL-12を産生した(図4)。IFN
存在下又は非存在下に前培養した脾細胞(p-spleen cells)は,共にLPS刺激に応答して相当量のIL-12を産生した(図4)。IFN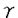 を加えずに前培養した場合、脾細胞が自らIFN
を加えずに前培養した場合、脾細胞が自らIFN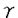 を産生し、それによってprimingされている可能性がある。そこで、IFN
を産生し、それによってprimingされている可能性がある。そこで、IFN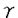 欠損マウスの脾細胞を用いて同様の実験を行ったが、野生型マウス脾細胞の場合と同様の結果であった。すなわち、脾細胞はIFN
欠損マウスの脾細胞を用いて同様の実験を行ったが、野生型マウス脾細胞の場合と同様の結果であった。すなわち、脾細胞はIFN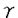 を加えずに前培養するだけでLPSによるIL-12産生能を獲得した。次に、前培養の効果とは何かを検討した。脾細胞のLPS刺激によってIL-10が産生され、IL-10がIL-12産生を抑制している可能性がある。そこで、抗IL-10を添加してIL-12産生を検討したところ、f-spleen cellsはLPS刺激によってIL-12を産生した。さらに、IFN
を加えずに前培養するだけでLPSによるIL-12産生能を獲得した。次に、前培養の効果とは何かを検討した。脾細胞のLPS刺激によってIL-10が産生され、IL-10がIL-12産生を抑制している可能性がある。そこで、抗IL-10を添加してIL-12産生を検討したところ、f-spleen cellsはLPS刺激によってIL-12を産生した。さらに、IFN 共存下では顕著な産生増強がみられ、その産生量はp-spleen cellsのそれと同レベルであった(図5)。次に、培養上清中のIL-10の産生量を検討した。f-spleen cellsとp-spleen cellsではLPS刺激によるIL-10産生量に差は見られなかった。この結果から、f-spleen cellsによるIL-12産生量が著しく低いのは、産生されるIL-10が多いからではなく、IL-10に対する反応性に差があるからであると考えられる。マウス脾細胞中でLPS刺激に反応してIL-12を産生する細胞は
共存下では顕著な産生増強がみられ、その産生量はp-spleen cellsのそれと同レベルであった(図5)。次に、培養上清中のIL-10の産生量を検討した。f-spleen cellsとp-spleen cellsではLPS刺激によるIL-10産生量に差は見られなかった。この結果から、f-spleen cellsによるIL-12産生量が著しく低いのは、産生されるIL-10が多いからではなく、IL-10に対する反応性に差があるからであると考えられる。マウス脾細胞中でLPS刺激に反応してIL-12を産生する細胞は である。そこで,f-spleen cellsとp-spleen cells中の
である。そこで,f-spleen cellsとp-spleen cells中の 上のIL-10レセプター(IL-10R)の発現について検討した。
上のIL-10レセプター(IL-10R)の発現について検討した。
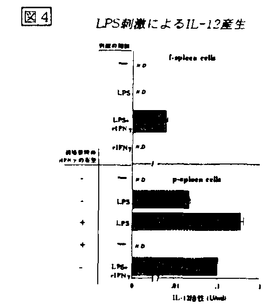 図4 LPS刺激によるIL-12産生
図4 LPS刺激によるIL-12産生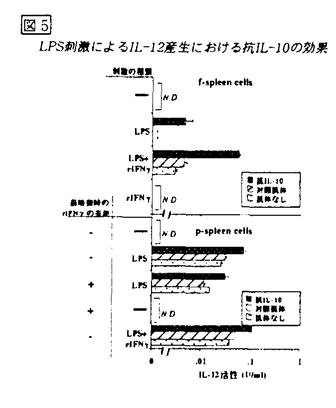 図5 LPS刺激によるIL-12産生における抗IL-10の効果
図5 LPS刺激によるIL-12産生における抗IL-10の効果 f-spleen cellsの は、無刺激ではIL-10Rを発現していないが、LPS刺激後2時間で発現がみられ、4時間後にはピークに達し、その後減少した.一方、p-spleen cellsの
は、無刺激ではIL-10Rを発現していないが、LPS刺激後2時間で発現がみられ、4時間後にはピークに達し、その後減少した.一方、p-spleen cellsの はLPS刺激後もIL-10Rをわずかに発現するに過ぎなかった(図6)。これらの結果から、f-spleen cells中の
はLPS刺激後もIL-10Rをわずかに発現するに過ぎなかった(図6)。これらの結果から、f-spleen cells中の は、p-spleen cells中の
は、p-spleen cells中の よりもIL-10R発現が高く、LPS刺激によって産生されたIL-10がf-spleen cellsによるIL-12産生をp-spleen cellsによるIL-12産生よりも強く抑制していると考えられる。
よりもIL-10R発現が高く、LPS刺激によって産生されたIL-10がf-spleen cellsによるIL-12産生をp-spleen cellsによるIL-12産生よりも強く抑制していると考えられる。
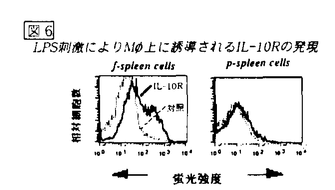 図6 LPS刺激により
図6 LPS刺激により 上に誘導されるIL-10Rの発現る。
上に誘導されるIL-10Rの発現る。 以上の結果よりT細胞依存的IL-12産生もLPS刺激によるIL-12産生も共にIL-10によるそ制御を受けていることがわかる。IL-12はTh細胞をTh1へと導くが、Th2-APCの相互反応ではIL-12は産生されないのでTh1/Th2バランスをTh1優位に導くことは難しい。一方、Th1-APC相互反応ではIL-12が産生されTh1/Th2バランスはさらにTh1側に傾く。LPS刺激によるIL-12産生においても、f-spleen cellsではLPS刺激によってIL-10が産生され、IL-10Rを発現してIL-10による負の制御をうけていると考える。LPS刺激の際IFN を共存させることはIL-12産生を増強する。しかし、LPS刺激によるIL-12産生にIFN
を共存させることはIL-12産生を増強する。しかし、LPS刺激によるIL-12産生にIFN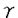 によるprimingは必須ではないと結論できる。
によるprimingは必須ではないと結論できる。