| 1.研究の背景および研究目的  1-アドレナリン受容体はその薬理学的性質により、1980年なかばからサブタイプの存在が報告されていたが、近年分子生物学的に、その構造も解明された。現在のところ、 1-アドレナリン受容体はその薬理学的性質により、1980年なかばからサブタイプの存在が報告されていたが、近年分子生物学的に、その構造も解明された。現在のところ、 1A、 1A、 1B、 1B、 1D(薬理学的)、あるいは 1D(薬理学的)、あるいは 1a、 1a、 1b、 1b、 1d(クローニシグされた場合)の少なくとも3種類のサブタイプの存在が確認されている。以来実験動物、ヒトの各臓器における 1d(クローニシグされた場合)の少なくとも3種類のサブタイプの存在が確認されている。以来実験動物、ヒトの各臓器における 1-アドレナリン受容体サブタイプの局在およびその分布密度に関する報告が散見されるようになってきているが、ヒト腎組織、および腎血管における 1-アドレナリン受容体サブタイプの局在およびその分布密度に関する報告が散見されるようになってきているが、ヒト腎組織、および腎血管における 1-アドレナリン受容体サブタイプの局在、分布密度について詳しく調べた報告は見当たらない。 1-アドレナリン受容体サブタイプの局在、分布密度について詳しく調べた報告は見当たらない。 本研究はヒト腎皮質および腎動脈における 1-アドレナリン受容体サブタイプの局在をin situ hybridizationにて検索し、その量と比率をRNase protection assayの手法をもちいて調べた。 1-アドレナリン受容体サブタイプの局在をin situ hybridizationにて検索し、その量と比率をRNase protection assayの手法をもちいて調べた。 2.研究方法 対象 46症例(平均±SD.,59.0±14.7歳)の腎細胞癌、腎盂癌もしくは、尿管癌患者および12症例(平均±SD.,68.7±7.6歳)の前立腺肥大症患者を対象とし、その手術時に組織を採取し、ただちに凍結保存した。 RNA probeの準備 まず 1-アドレナリン受容体各サブタイプ( 1-アドレナリン受容体各サブタイプ( 1a, 1a, 1b,および 1b,および 1d)それぞれに対する特異的RNAプローブを作成した。 1d)それぞれに対する特異的RNAプローブを作成した。 1a、 1a、 1b、 1b、 1d fragmentをそれぞれpBluescript transcription vectorに挿入し、in vitro transcriptionにて、各サブタイプにたいするRNA probeを作成した。in situ hybridizationにもちいるためにantisense RNA probeはジゴキシゲニン-UTPで標識した。またRNase protection assayにもちいるために[ 1d fragmentをそれぞれpBluescript transcription vectorに挿入し、in vitro transcriptionにて、各サブタイプにたいするRNA probeを作成した。in situ hybridizationにもちいるためにantisense RNA probeはジゴキシゲニン-UTPで標識した。またRNase protection assayにもちいるために[ -32P]で標識した。 -32P]で標識した。 in situ hybridizationまず凍結した腎皮質および腎動脈組織を10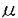 mに薄切した後、4%パラホルムアルデヒド溶液にて固定した。その後0.2N塩酸およびproteinase K処理の後、10分間アセチル化をおこない、その後45℃で2時間prehybridizationを施行した。以上の処理の後digoxigeninでラベルしたプローベをもちいて45℃で16時間hybridizationをおこなった。そしてRNase Aで処理の後、抗digoxigenin抗体をもちいてincubateし、12時間発色反応をおこなった。 mに薄切した後、4%パラホルムアルデヒド溶液にて固定した。その後0.2N塩酸およびproteinase K処理の後、10分間アセチル化をおこない、その後45℃で2時間prehybridizationを施行した。以上の処理の後digoxigeninでラベルしたプローベをもちいて45℃で16時間hybridizationをおこなった。そしてRNase Aで処理の後、抗digoxigenin抗体をもちいてincubateし、12時間発色反応をおこなった。 RNAの準備まず腎皮質組織、腎動脈および前立腺組織の凍結組織を液体窒素の中で乳鉢と乳棒をもちいてhomogenizeし全RNAをそれぞれ抽出した。全RNAはoligotex(dT)resinと混ぜ合わせ、bound poly(A)+RNAを溶出させ、これをRNase protection assayを施行する時まで、-80℃で保存した。 RNase protection assay腎皮質、腎動脈および前立腺組織から抽出したPoly(A)+RNA(5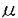 g)のサンプルをそれぞれ放射性同位元素でラベルした3種類のサブタイプに対するantisense RNA probeをもちいて42℃で、12時間hybridizationをおこなった。ただし腎動脈については、主腎動脈と分岐腎動脈とに分けて検索した。また腎動脈組織からは少量のRNAサンプルしか得られないため、それぞれ7症例ずつ混合し3グループに分割した。Hybridizationの後、Proteinase K処理をし、polyacrylamide denaturing gel上に分画した。imaging plateをdry gelに曝し、imaging analyserをもちいて各サブタイプmRNAの検出および定量をおこなった。 g)のサンプルをそれぞれ放射性同位元素でラベルした3種類のサブタイプに対するantisense RNA probeをもちいて42℃で、12時間hybridizationをおこなった。ただし腎動脈については、主腎動脈と分岐腎動脈とに分けて検索した。また腎動脈組織からは少量のRNAサンプルしか得られないため、それぞれ7症例ずつ混合し3グループに分割した。Hybridizationの後、Proteinase K処理をし、polyacrylamide denaturing gel上に分画した。imaging plateをdry gelに曝し、imaging analyserをもちいて各サブタイプmRNAの検出および定量をおこなった。 3.結果 in situ hybridization腎皮質においては、 1a, 1a, 1b, 1b, 1dすべてのサブタイプが主として弓状動脈、小葉間動脈、細動脈において認められた。動脈系おいては中膜の平滑筋細胞に主として存在した。一方尿細管においては尿細管上皮細胞に、糸球体においては内皮細胞に、3種のサブタイプがそれぞれ軽度に発現した。腎皮質における 1dすべてのサブタイプが主として弓状動脈、小葉間動脈、細動脈において認められた。動脈系おいては中膜の平滑筋細胞に主として存在した。一方尿細管においては尿細管上皮細胞に、糸球体においては内皮細胞に、3種のサブタイプがそれぞれ軽度に発現した。腎皮質における 1-アドレナリン受容体の局在については、サブタイプの種類によらず同様であり、またび漫性であった。腎動脈においても同様に3種のサブタイプすべてが主として中膜の筋層に認められた。 1-アドレナリン受容体の局在については、サブタイプの種類によらず同様であり、またび漫性であった。腎動脈においても同様に3種のサブタイプすべてが主として中膜の筋層に認められた。 RNase protection assay 22症例の腎皮質組織、21症例の腎動脈組織、および12症例の肥大前立腺組織から得られた全RNAについて、RNase protection assayの手法をもちいて、3種の 1-アドレナリン受容体サブタイプmRNAの発現量を定量し、3種のサブタイプの発現量の比較をした。腎皮質組織における主たる 1-アドレナリン受容体サブタイプmRNAの発現量を定量し、3種のサブタイプの発現量の比較をした。腎皮質組織における主たる 1-アドレナリン受容体サブタイプは 1-アドレナリン受容体サブタイプは 1aであった。しかし腎組織における 1aであった。しかし腎組織における 1a-アドレナリン受容体サブタイプmRNAの発現量は、前立腺における 1a-アドレナリン受容体サブタイプmRNAの発現量は、前立腺における 1a mRNAに較べ極微量であった(-102 fold)。腎動脈については、主腎動脈、分岐腎動脈に分け、それぞれ7症例ずつ3グループに分割して、RNase protection assayにて定量をおこなった。腎動脈においては、主腎動脈,分岐腎動脈ともに主たる 1a mRNAに較べ極微量であった(-102 fold)。腎動脈については、主腎動脈、分岐腎動脈に分け、それぞれ7症例ずつ3グループに分割して、RNase protection assayにて定量をおこなった。腎動脈においては、主腎動脈,分岐腎動脈ともに主たる 1-アドレナリン受容体サブタイプはいずれのグループにおいても 1-アドレナリン受容体サブタイプはいずれのグループにおいても 1aであった。 1aであった。 1dサブタイプmRNAは主、分岐腎動脈いずれにおいても, 1dサブタイプmRNAは主、分岐腎動脈いずれにおいても, 1aサブタイプに比較して明かに発現量が少なく、 1aサブタイプに比較して明かに発現量が少なく、 1bサブタイプmRNAはごくわずかに検出できたのみであった。 1bサブタイプmRNAはごくわずかに検出できたのみであった。 4.考察  1-アドレナリン受容体には, 1-アドレナリン受容体には, 1A( 1A( 1a), 1a), 1B( 1B( 1b)および 1b)および 1D( 1D( 1d)の少なくとも3種のサブタイプが存在することが明らかにされている。これまで種々の実験動物、およびヒトの各種臓器における 1d)の少なくとも3種のサブタイプが存在することが明らかにされている。これまで種々の実験動物、およびヒトの各種臓器における 1-アドレナリン受容体の分布が調べられてきており、種あるいは、各種臓器においてその分布が異なることが示唆されている。腎組織における 1-アドレナリン受容体の分布が調べられてきており、種あるいは、各種臓器においてその分布が異なることが示唆されている。腎組織における 1-アドレナリン受容体サブタイプについての報告はまれではあるが、ラット腎臓における 1-アドレナリン受容体サブタイプについての報告はまれではあるが、ラット腎臓における 1-アドレナリン受容体の主たる存在部位が、その腎皮質であるとの報告がみられる。ヒト動脈系に関しては大動脈において 1-アドレナリン受容体の主たる存在部位が、その腎皮質であるとの報告がみられる。ヒト動脈系に関しては大動脈において 1d-サブタイプが、ヒト腸骨動脈において 1d-サブタイプが、ヒト腸骨動脈において 1B-サブタイプが、そして腸間膜動脈において 1B-サブタイプが、そして腸間膜動脈において 1Hあるいは 1Hあるいは 1Aが、冠動脈において 1Aが、冠動脈において 1H(B)が主として存在するとの報告がみられる。しかしながらヒト腎皮質、腎動脈におけるサブタイプの分布やその密度については明らかにされていない。 1H(B)が主として存在するとの報告がみられる。しかしながらヒト腎皮質、腎動脈におけるサブタイプの分布やその密度については明らかにされていない。 本研究でわれわれはin situ hybridizationの手法をもちいて 1-アドレナリン受容体サブタイプmRNAが腎皮質においては主として動脈系、特に筋層にまんべんなく存在し、かつこれらはサブタイプによらず同様のパターンを示すことを証明した。動脈系(弓状動脈、小葉間動脈、細動脈)のDig-Eliza法による染色は、尿細管、糸球体に較べてより強いものであった。腎動脈においても同様に3種のサブタイプはいずれも主として中膜の平滑筋層にび漫性に存在し、 1-アドレナリン受容体サブタイプmRNAが腎皮質においては主として動脈系、特に筋層にまんべんなく存在し、かつこれらはサブタイプによらず同様のパターンを示すことを証明した。動脈系(弓状動脈、小葉間動脈、細動脈)のDig-Eliza法による染色は、尿細管、糸球体に較べてより強いものであった。腎動脈においても同様に3種のサブタイプはいずれも主として中膜の平滑筋層にび漫性に存在し、 1aサブタイプが他のサブタイプに較べてより強く発現する傾向がみられた。各サブタイプの量およびその比率を比較するためにさらに、RNase protection assayをおこなった。この方法により著者は腎皮質においては 1aサブタイプが他のサブタイプに較べてより強く発現する傾向がみられた。各サブタイプの量およびその比率を比較するためにさらに、RNase protection assayをおこなった。この方法により著者は腎皮質においては 1aサブタイプが主たるサブタイプであることを証明した。また主腎動脈、分岐腎動脈において 1aサブタイプが主たるサブタイプであることを証明した。また主腎動脈、分岐腎動脈において 1aサブタイプは 1aサブタイプは 1dに較べて明らかに多量に存在し、 1dに較べて明らかに多量に存在し、 1bがごくわずかしか存在しない 1bがごくわずかしか存在しない ことを示した。このことがヒト腎動脈における 1-アドレナリン受容体サブタイプの特徴であると考えられる。しかしながら前立腺における 1-アドレナリン受容体サブタイプの特徴であると考えられる。しかしながら前立腺における 1aサブタイプの量に較べて腎皮質、腎動脈における 1aサブタイプの量に較べて腎皮質、腎動脈における 1aサブタイプの量は微量であった。この理由の一つとしては、腎皮質における平滑筋の含有量が、前立腺に較べて少ないことが考えられる。いま一つの理由としては血流遮断後、凍結保存するまでの時間が腎組織において、より長時間を要したためと考えられる。 1aサブタイプの量は微量であった。この理由の一つとしては、腎皮質における平滑筋の含有量が、前立腺に較べて少ないことが考えられる。いま一つの理由としては血流遮断後、凍結保存するまでの時間が腎組織において、より長時間を要したためと考えられる。 ノルアドレナリン刺激あるいは交感神経刺激は 1-アドレナリン受容体を介して血管の収縮をもたらし、全身的には高血圧症の原因となり、局所的には腎血流量、糸球体濾過量の減少をもたらす。 1-アドレナリン受容体を介して血管の収縮をもたらし、全身的には高血圧症の原因となり、局所的には腎血流量、糸球体濾過量の減少をもたらす。 1-アドレナリン受容体サブタイプの中で、腎皮質および腎動脈において 1-アドレナリン受容体サブタイプの中で、腎皮質および腎動脈において 1a-サブタイプの量が最も多いサブタイプであることを考慮すると、 1a-サブタイプの量が最も多いサブタイプであることを考慮すると、 1a-サブタイプに対し特異的な拮抗薬の利用により、腎血流量、糸球体濾過量を増加させ、さらに、腎機能の悪化を予防する可能性を秘めていると考えられる。 1a-サブタイプに対し特異的な拮抗薬の利用により、腎血流量、糸球体濾過量を増加させ、さらに、腎機能の悪化を予防する可能性を秘めていると考えられる。 5.まとめ 腎皮質における 1-アドレナリン受容体サブタイプはいずれも主として腎内の動脈系に存在し、糸球体、尿細管にはわずかに存在した。腎動脈においては、主として中膜の筋層に3種のサブタイプが存在した。(in situ hybridization)。 1-アドレナリン受容体サブタイプはいずれも主として腎内の動脈系に存在し、糸球体、尿細管にはわずかに存在した。腎動脈においては、主として中膜の筋層に3種のサブタイプが存在した。(in situ hybridization)。 また 1-アドレナリン受容体サブタイプの量と比率の検討では、腎皮質、腎動脈いずれにおいても 1-アドレナリン受容体サブタイプの量と比率の検討では、腎皮質、腎動脈いずれにおいても 1a-サブタイプが主として存在した(RNase protection assay)。 1a-サブタイプが主として存在した(RNase protection assay)。 以上の結果からヒト腎皮質内の動脈系、ヒト腎動脈いずれにおいても 1-アドレナリン受容体サブタイプのうち、 1-アドレナリン受容体サブタイプのうち、 1a-サブタイプが主として存在し、ノルアドレナリンあるいは交感神経刺激に対して重要な役割をはたしていると考えられた。 1a-サブタイプが主として存在し、ノルアドレナリンあるいは交感神経刺激に対して重要な役割をはたしていると考えられた。 |