アルツハイマー病(Alzheimer’s disease;AD)は進行性の痴呆を伴う中枢神経系の神経変性疾患である。常染色体優性遺伝形式で発症する早期発症型家族性アルツハイマー病(FAD)の家系を用いて病因遺伝子の探索が行われ、アミロイド前駆体蛋白質、プレセニリン1、2の3遺伝子が病因遺伝子として確立している。この中でプレセニリン1(PS1)は、FADの大半を説明できる遺伝子である。本研究の目的はAD発症機構におけるPS1遺伝子変異の役割の解明である。 PS1代謝におけるプロテアソームの役割 PS1は467アミノ酸から成る膜タンパク質であり、培養細胞・脳組織中では標準型切断を受け、N末端フラグメントとC末端フラグメントとして存在している。現在までに報告された40種類以上の変異の約3分の1は、標準型切断部位近傍に存在している。FAD変異の1つは、標準型切断部位を欠損している。以上の事実はPS1の切断反応あるいは、フラグメントは生理的に重要な役割を果たしている可能性を示唆する。そこで本研究では、PS1蛋白質の代謝に焦点を当て詳細に検討した。 ヒト神経芽細胞腫SH-SY5Yを用いて正常型PS1の過剰発現細胞(SW14)を作製し、種々のプロテアーゼ阻害剤のPS1代謝に対する効果を検討した。用いた阻害剤の中で、プロテアソーム阻害活性を有するCal I、Cal II、MG132、dichloroisocoumarinは、全長型PS1を蓄積させた。さらに、プロテアソームの特異的阻害剤ラクタシスチンも全長型PS1を蓄積させたことから、プロテアソームがPS1の代謝に関与していると結論した。全長型PS1ほど顕著ではないが、N末端、C末端フラグメントもラクタシスチンの濃度依存的に蓄積した。この結果は、両フラグメントはプロテアソームにより分解されることを示唆する。また野生型のSH-SY5YにCal Iを作用させたときにも全長型PS1の蓄積が観察されたことから、プロテアソームによるPS1の代謝はPS1の過剰発現細胞に特異的な現象ではなく生理的に機能していることが明らかとなった。そこで、プロテアソームが全長型PS1の分解あるいは標準型切断のいずれに関与しているのか検討した。エクソン10の欠損変異型PS1(dex10変異PS1)は切断部位を欠損しているため、標準型切断を受けず「全長型」として存在している。この変異型PS1もCal I処理により全長型が蓄積した。この結果、プロテアソームが全長型PS1の分解に関与していることが示唆された。プロテアソームによる蛋白質分解にはユビキチンの関与が知られているが、阻害剤処理より蓄積したPS1は単一バンドとして検出され、高分子量領域にもバンドが観察されなかったことから、ユビキチン化がプロテアソームによるPS1の代謝に必ずしも必要ではない可能性が示唆された。標準型切断を受ける1アミノ酸置換を伴う変異型PS1(Leu392Val変異とCys410Tyr変異)も、Cal I処理により全長型PS1が蓄積し、PS1の変異がプロテアソームに対する感受性に大きな影響を与えないことが示唆された。 次に、標準型切断について検討した。標準型切断部位を含む合成ペプチドを、ウシ20Sプロテアソームで分解し、matrix-assisted laser desorption/ionization-time-of-flight-mass spectroscopy、またはアミノ酸配列解析を行い切断部位を決定した。同定されたTyr288,Ser289,Met298,Ala299の4カ所のうちMet298,Ala299は標準型切断部位として報告されており、プロテアソームの標準型切断への関与が示唆された。35S-Metで15分間ラベルした細胞をN末端側に対する抗体MKAD3.3で免疫沈降し、全長型PS1とN末端フラグメントを定量した。細胞をCal Iで前処理するとN末端フラグメントの産生量が有意に減少し、Cal Iが標準型切断を阻害することが示された。しかし、阻害剤の濃度を増加させてもN末端フラグメントの産生を完全には阻害出来なかったことから、標準型切断にはプロテアソーム以外の酵素の関与も示唆された。さらに、免疫沈降させたPS1を免疫複合体ごとプロテアソームと反応させると、N末端フラグメント量の増加とC末端フラグメントと思われるバンドが出現し、プロテアソームが標準型切断に関与していることがin vitroでも示された。しかし、この実験ではPS1がプロテアソームに対して比較的耐性を示し、標準型以外の切断も認められた。これは、PS1が膜内に局在していることが、プロテアソームによる分解及び切断に必要である可能性を示唆している。 プロテアソームの部位特異的な切断反応への関与は、転写因子NF Bのp50サブユニットが前駆体p105蛋白質からプロセスされる課程、サイクリンBの分解過程における最初の切断の2例が報告されている。PS1の生理的機能については現在不明であるが、プロテアソームの分解と標準型切断への関与を考えると、細胞内情報伝達機構など、細胞内で重要な役割を果たしている可能性が考えられる。 Bのp50サブユニットが前駆体p105蛋白質からプロセスされる課程、サイクリンBの分解過程における最初の切断の2例が報告されている。PS1の生理的機能については現在不明であるが、プロテアソームの分解と標準型切断への関与を考えると、細胞内情報伝達機構など、細胞内で重要な役割を果たしている可能性が考えられる。 PS1の細胞内局在とFAD変異の関係 ヒトPS1の第6ループ部分に対する抗体M5とhL312を作製した。抗原として使用したペプチドはどちらもC末端フラグメント上に位置する。Western blotで、hL312は全長型PS1もC末端フラグメントも認識したが、M5はC末端フラグメントだけを認識し全長型PS1を認識しなかった。全長型PS1はC末端フラグメントに比べて量が少ないため、M5が認識できない可能性が考えられたので、細胞をCal I処理し、全長型PS1を蓄積させた後解析したが全長型PS1を認識しなかった。M5のエピトープを決定したところ302-308の配列(DPEAQRR)が同定された。また、M5は切断部位から始まる合成ペプチドAD2M(Cys+299-313)により濃度依存的に吸収阻害され、10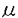 MではM5を完全に阻害したが、切断部位を越えてN末端側に18アミノ酸延長したペプチドL281(281-311)では最大でも14%しか阻害できなかった。これらの結果は、M5は標準型切断の結果新たに生じるC末端フラグメントのフリーのN末端断端を認識する抗体ではなく、PS1の切断に依存してC末端フラグメントだけを特異的に認識する抗体であると考えられる。 MではM5を完全に阻害したが、切断部位を越えてN末端側に18アミノ酸延長したペプチドL281(281-311)では最大でも14%しか阻害できなかった。これらの結果は、M5は標準型切断の結果新たに生じるC末端フラグメントのフリーのN末端断端を認識する抗体ではなく、PS1の切断に依存してC末端フラグメントだけを特異的に認識する抗体であると考えられる。 C末端フラグメントのみを認識し全長型PS1を認識しないM5抗体の性質を利用し、hL312とともに細胞を免疫染色することにより、C末端フラグメンドと全長型PS1の細胞内局在を識別した。M5によるSW14細胞の免疫染色により、C末端フラグメントはほとんどが小胞体に存在することが示された。hL312はM5と同じく小胞体を染色したが、核膜も染色した。核膜の染色は、細胞をCal Iで処理し全長型PS1を蓄積させると強調された。一方、M5はCal Iで処理しても核膜を染色しなかったことから、Cal I処理により蓄積した全長型PS1は核膜に局在し、C末端フラグメントとは異なった局在を示すことが明らかとなった。 次に、FAD変異を持つPS1の細胞内局在を検討した。dex10変異PS1とL392V変異PS1を発現させた細胞は、hL312で核膜が染色されず、全長型PS1とフラグメント型PS1は小胞体に共存していた。特に、dex10変異PS1は、標準型切断を受けず「全長型」として蓄積しているにもかかわらず、正常型PS1とは異なり核膜に局在していなかった。これらの結果から、FAD変異を持つ全長型PS1は核膜への局在が阻害されていることが示唆された。 ラット副腎髄質褐色細胞腫PC12は、NGFにより神経細胞に分化させることができる。未分化のPC12中では全長型PS1が少量観察され、ほとんどはN末端、C末端フラグメントとして存在していたが、NGF処理により6時間後に全長型PS1の蓄積が観察された。NGFの効果は、NGFの細胞内シグナル伝達経路のMEKの阻害剤PD98059により完全にブロックされた。この結果は、NGF刺激のような分化増殖シグナルに応答して全長型PS1がin vivoでも蓄積する可能性を示唆する。 最近PS1と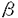 -カテニンとの結合が報告され、FAD変異を持つPS1は、 -カテニンとの結合が報告され、FAD変異を持つPS1は、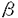 -カテニンを不安定化させたり、核内への移行を阻害することが示された。特に後者の例は、PS1をノックアウトした細胞では -カテニンを不安定化させたり、核内への移行を阻害することが示された。特に後者の例は、PS1をノックアウトした細胞では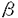 -カテニンは正常に核内に移行することから、FAD変異の異常機能の獲得を示唆している。FAD変異が -カテニンは正常に核内に移行することから、FAD変異の異常機能の獲得を示唆している。FAD変異が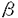 -カテニンの核内移行に対して阻害的に働く機構は、本研究で明らかとなったFAD変異を持つ全長型PS1が核膜に移行しないという機構と関わっている可能性があり大変興味深い。 -カテニンの核内移行に対して阻害的に働く機構は、本研究で明らかとなったFAD変異を持つ全長型PS1が核膜に移行しないという機構と関わっている可能性があり大変興味深い。 まとめ 本研究の結果、全長型PS1は核膜に局在することが示され、小胞体に存在するフラグメント型PS1とは異なる役割を持っている可能性が示唆された。またFADでは未切断の変異型PS1が小胞体に存在する機能型と考えられているフラグメント型PS1の機能を阻害し、異常な機能を獲得する可能性が示唆された。今後は、PS1の細胞内局在を考慮し、PS1の機能とアルツハイマー病発症過程について検討したい。 |