近年、細胞周期の制御を担う蛋白質およびその遺伝子が同定されてきている。細胞周期の進行は、各種サイクリン/サイクリン依存性リン酸化酵素(CDK)複合体のリン酸化活性の制御による。CDKインヒビターはサイクリン/CDK複合体に特異的に結合しそのリン酸化活性を抑制する蛋白質群を呼ぶ。 p57Kip2は、CDKインヒビターとして同定されたCip/Kip familyに属する蛋白質である。Cip/Kip familyは、p57Kip2の他にp21Cip1,p27Kip1が知られている。これらは互いにCDK阻害領域を有しこの領域で高い相同性を示す。p57Kip2は,プロリンを多く含むプロリン領域やグルタミン酸を多く含むグルタミン酸領域といったp21Cip1,p27Kip1にはみられない構造を持っている。p57Kip2は培養細胞での過剰発現により細胞のG1期停止を促す。 またp57Kip2遺伝子は、ヒトでは染色体11番p15.5に存在している。この領域はゲノムインプリンティングを受ける領域であり、p57Kip2遺伝子は母親由来の遺伝子からのみ発現する。ある種の腫瘍組織に、この領域の欠損あるいはゲノムインプリンティングの破綻が認められることがある。また胎児や新生児の巨大症、臍帯ヘルニアを主徴とする遺伝疾患であるBeckwith-Wiedemann症候群(BWS)でもこの領域の異常がみられる。これらのことは、ヒト染色体11番p15.5に癌抑制遺伝子もしくはBWSの原因遺伝子が含まれる可能性を示唆した。p57Kip2はCDKインヒビターであるということも併せると、癌抑制遺伝子/BWSの原因遺伝子の有力な候補と考えられている。 p57Kip2の生理的役割を調べるため、本遺伝子の欠損マウスをジーンターゲッテイング法により作製した。p57Kip2と発癌、BWSの関連を知ることを目的としその解析を行なった。 I.p57Kip2欠損マウスの作製 マウスp57Kip2遺伝子は4つのエキソンからなる構造を持つ。これらのエキソンは約3kbの範囲に含まれ、蛋白質翻訳域は第二エキソンと第三エキソンに収まることが確認された。そこで蛋白質翻訳域を完全にネオマイシン副性遺伝子に置き換えるターゲッテイングベクターをデザインし作製した。 ターゲッティングベクターを129系マウス由来のES細胞株であるE14にエレクトロポレーション法にてトランスフェクションを行ない、G418とgancyclovirとの二重選択を8日間行なった。生き残ってきたES細胞のコロニーを選別し各コロニーから調製した遺伝子について相同組換えの有無をサザンブロテイング法により確認した。192クローン中26クローンにて相同組換えがうまくいっていた。陽性ES細胞クローンはC57B6マウスの受精卵にマイクロインジェクション法で植え付けを行ない、偽妊娠マウス(ICRマウスを用いた)の子宮に着床させ、キメラマウスの誕生を待った。更に雄キメラマウスと雌C57B6マウスとの交配で変異遺伝子の継代のできた時に得られるp57ヘテロマウスの雌雄同士を交配させ、p57Kip2遺伝子欠損マウス(p57-/-)を獲得した。 II.p57Kip2欠損マウスの表現型(新生児) p57ヘテロマウス同士の交配よりp57-/-マウスが得られた。新生児の各遺伝型の割合はメンデル則に有意に従っていた。しかしながら殆どのp57-/-とp57ヘテロマウスの約半数は生後24時間以内に死んだ。また、雄p57ヘテロマウスと雌野性型(WT)マウスとの交配で生まれてきたp57ヘテロマウスに異常を観察できなかったが、逆に雄WTマウスと雌p57ヘテロマウスとの交配で得られるp57ヘテロマウスの多くは、p57-/-と同様に24時間以内に死んだ。p57Kip2遺伝子はゲノムインプリンティングを受けて、母親由来の領域からのみの発現をする遺伝子であるが、この組み合わせの交配で生まれるp57ヘテロマウスではp57Kip2遺伝子は父親由来からのみ遺伝し母親由来の領域が変異している。このためこのp57ヘテロマウスではp57Kip2蛋白質の発現ができなくなりp57-/-と同様の表現型を示した。 p57-/-は生後まもなく呼吸不全を示し空気が胃、腸管内に溜まって、腹部膨満を呈した。組織病理的解析からこれらの個体で軟骨形成不全による口蓋裂が認められ、これが呼吸不全の原因と確認された(図1)。 アルシアン青(軟骨)、アリザリン赤(真骨)による骨の二重染色により、p57-/-の頭骸骨の染色がWTに比べて劣っており、骨形成不全が顕著であった(図2)。 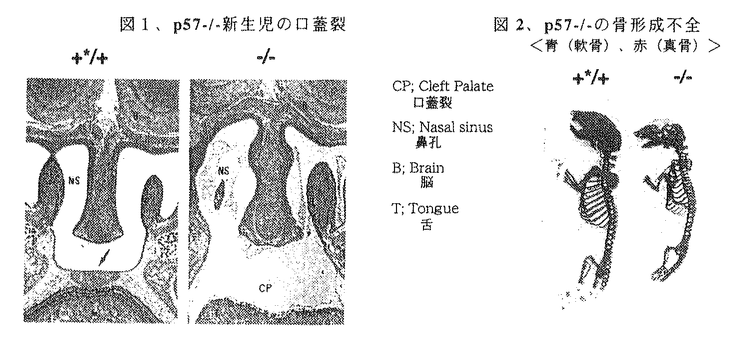 図表図1、p57-/-新生児の口蓋裂 / 図2、p57-/-の骨形成不全 <青(軟骨)、赤(真骨)> 図表図1、p57-/-新生児の口蓋裂 / 図2、p57-/-の骨形成不全 <青(軟骨)、赤(真骨)> p57Kip2は正常な骨形成の進行に不可欠であることが明らかとなった。 III.p57Kip2欠損マウスの表現型(生き残り) p57-/-の殆どは新生児期に死んでしまうが、約一割は新生児期を過ぎても生き残っていた。これらのマウスはその寿命が2週間から半年以上とばらつきを示した。 顕著な異常として体のサイズが極めて小さいことか観察された。その体重はWTの1/4から1/2程度であった(図3)。  図3、p57-/-生き残りマウス(3週齢)手前の小さい個体がp57-/- 図3、p57-/-生き残りマウス(3週齢)手前の小さい個体がp57-/- 生後5週間後のマウスについて組織病理的解析を行なった結果、精嚢、前立腺、子宮の発育不全が認められた。卵巣では閉鎖卵胞が増加していた。また副腎皮質細胞の脂肪滴が減少していた。更に雌の生き残りp57Kip2欠損マウスでは膣閉塞が認められた。 体のサイズが小さい、生殖器官の発育不全を示すといった所見から性ホルモン分泌異常が起きている事が考えられた。 またこれらの個体で腫瘍組織を確認することができず、またこれらの知見はBeckwith-Wiedemann症にみられる主徴とも一致しなかった。p57-/-の個体レベルでの解析ではp57Kip2遺伝子を癌抑制遺伝子/Beckwith-Wiedemann症候群の原因遺伝子であることを支持する所見は得られなかった。 IV.p57Kip2欠損マウス胎児の絨毛細胞の異常増殖 雌p57ヘテロマウスは極めて高い頻度で早産を示した。雌WTマウスは雄がWT、p57ヘテロどちらの場合でも受精後20.5日目で出産したのに対し、雌p57ヘテロマウスはその多くが受精後18.5日目に出産した(表1)。これの原因を調べることため胎盤について解析を行なった。 胎盤の湿重量を受精後13.5日から17.5日まで測定したところp57欠損胎児胎盤はWTのものに比べて有意に重く、p57Kip2欠損による胎盤の肥大が認められた(図4)。尚、胎盤の肥大はBWSでも報告されている。 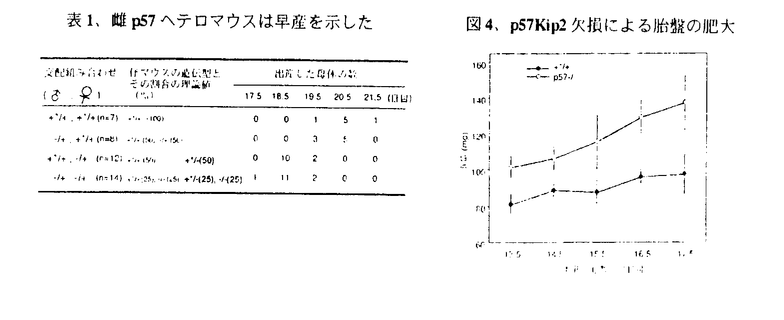 図表表1、雌p57ヘテロマウスは早産を示した / 図4、p57Kip2欠損による胎盤の肥大 図表表1、雌p57ヘテロマウスは早産を示した / 図4、p57Kip2欠損による胎盤の肥大 組織病理的解析を行なったところ絨毛細胞の異常増殖像がp57-/-で観察された。また異型細胞の出現もみとめられた。顕微鏡下で胎盤を構成する細胞について一定面積中の数を測定した。p57-/-胎盤における絨毛細胞はWTに比べて1.3〜2倍になっていた。 胎盤でのp57Kip2mRNA発現を細胞レベルでみるため、組織切片についてIn situハイブリダイゼイションを行なった。WTでの発現が絨毛細胞に認められたが、絨毛細胞の異常増殖を示したp57-/-ではその発現が検出されなかった。 ここに観察された絨毛細胞の異常増殖はp57Kip2蛋白質が欠失したことによるCDKの活性化によるものではないかと予想し、胎盤の蛋白質画分について解析をした。 胎盤でのp57Kip2発現は線維芽細胞と同様にその遺伝型に従っていた。p27Kip1の発現も遺伝型によらず同じ程度のレベルで有意に検出されたが、p21Cip1はどの遺伝型でも検出できなかった。CDK2、CDK4の発現レベル、そのリン酸化活性について検討したが、遺伝型による違いは認められなかった。 絨毛細胞の異常増殖はCDKの活性化にとは別のメカニズムによる事が示唆された。 V.ヒト絨毛性腫瘍におけるp57Kip2発現 p57Kip2欠損胎児の胎盤でみられた絨毛細胞の異常増殖と異型細胞の出現は、ヒトの絨毛性腫瘍(胞状性奇体、侵入奇体、絨毛癌)に類似した所見であった。 ヒト絨毛性腫瘍組織におけるp57Kip2蛋白質の発現を組織免疫染色により検討した。正常のヒト絨毛細胞でp57Kip2の発現がみられたが、侵入奇体や悪性絨毛癌組織では検出されないか陽性でもその程度は弱かった。 治癒には早期処置が求められるが、摘出された腫瘍組織のp57Kip2の免疫染色による検出が絨毛性腫瘍の術後の早期処置の判断法として有効である事が期待された。 VI.結論 p57Kip2蛋白質は個体発生段階における骨形成に必要な分子であることが明らかとなった。成体では主に生殖に関わる器官の正常な形成に本蛋白質が必要であることが明らかとなった。マウスではp57Kip2遺伝子が癌抑制遺伝子/BWSの原因遺伝子である可能性を胎盤での所見でのみ認められた。 ヒト絨毛性腫瘍におけるp57Kip2蛋白質の発現レベルが正常組織に比べ顕著に低いことが認められ、臨床におけるp57Kip2検出の有用性が期待された。 ヒトにおいて絨毛性腫瘍が早産の原因となるケースは非常に多く、絨毛細胞の異常増殖及び早産を呈したp57Kip2欠損マウスは早産のメカニズムを分子レベルで解析する材料となりうる可能性が示された。 |