G-CSFは、好中球の分化・増殖作用を有するサイトカインであり、現在では癌化学療法、放射線治療、骨髄移植後の好中球減少症の回復のために臨床的に用いられ、劇的な効果が確認されている。G-CSFの主要な産生細胞はマクロファージと造血組織のストローマ細胞であるが、G-CSFの生理的な産生機構についてはほとんどわかっていない。本研究では、G-CSFの生理的な産生機構、特に細胞接着依存的なG-CSF産生に着目し、そこに介在する分子について生化学的な解析をおこなった。 (1)G-CSF誘導の簡便な検出系の作製 従来、G-CSF誘導の検出系としては、G-CSF依存性の細胞を用いたバイオアッセイ、特異抗体を用いたイムノアッセイ、mRNA量の測定などの方法が使われてきた。これらの方法よりも手間、コスト、感度の面で優れた方法として、ルシフェラーゼレポータージーンアッセイを用いるG-CSFの誘導検出系を作製した。レポータージーンアッセイは、マーカー遺伝子の活性(発色や発光)で目的の遺伝子の発現を検出する方法であり、この方法を応用し、G-CSF遺伝子産物の誘導を定量的に簡便に解析することを可能にした。 具体的には、マウスG-CSFの転写制御領域を含む転写開始点上流1.7kbの遺伝子断片をクローニングし、ルシフェラーゼ遺伝子の上流に挿入したベクターを構築し、G-CSF産生細胞であるマクロファージ系細胞株3種(RAW264.7、J774.1、PU5-1.8)および造血ストローマ細胞3種(ST-2、HESS-1、HESS-5)に導入して安定形質転換細胞株を樹立した。これら細胞について、リポ多糖(lipopolysaccharide:LPS)刺激によりスクリーニングをおこない、最も鋭敏に反応するマクロファージ系RAW264.7細胞由来cl.27-3とストローマ系ST-2由来cl.11をそれぞれ選び、以降の実験に供した。 (2)細胞接着依存的G-CSF誘導機構の解析 単球が血液中から炎症局所へ浸潤する際に、細胞外マトリクス分子と接触し、活性化されて組織型マクロファージになる現象が知られている。このときに、IL-1、TNF-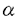 などの急性期タンパク質(immediate-early protein)が産生誘導されることは知られていたが、G-CSFについては全く知られていなかった。そこで、作製した検出系を用いてECMとの接着依存的なG-CSF産生誘導を測定した。マクロファージをプレート上に固相化したECMと接着させたところ、vitronectin>fibronectin>lamininの順に強く、G-CSFが誘導された。これらECM分子の一部に共通の、接着に必須な配列(Arg-Gly-Asp:integrinにより認識される配列)を含むペプチドポリマーとの接着によってもG-CSFが誘導された。また、fibronectinによるG-CSF誘導はいくつかのintegrin抗体により一部抑制された。したがって、 などの急性期タンパク質(immediate-early protein)が産生誘導されることは知られていたが、G-CSFについては全く知られていなかった。そこで、作製した検出系を用いてECMとの接着依存的なG-CSF産生誘導を測定した。マクロファージをプレート上に固相化したECMと接着させたところ、vitronectin>fibronectin>lamininの順に強く、G-CSFが誘導された。これらECM分子の一部に共通の、接着に必須な配列(Arg-Gly-Asp:integrinにより認識される配列)を含むペプチドポリマーとの接着によってもG-CSFが誘導された。また、fibronectinによるG-CSF誘導はいくつかのintegrin抗体により一部抑制された。したがって、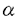 5 5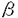 1(fibronectin receptor)をはじめとするいくつかのintegrinが、G-CSFの産生誘導に関与していることがわかった。また、fibronectinをプレートに固相化せず溶液状で細胞に加えた場合や、fibronectinと接着させた培養上清を添加した場合にはG-CSF誘導は観察されず、ECMへの細胞接着が、直接G-CSFの産生誘導を引き起こすことが明らかになった。また、ストローマの場合にも、固相化したcollagenやfibronectinとの接着により、G-CSF誘導が誘起され、ストローマにもマクロファージと同様にECMで活性化される機構が存在することがわかった。 1(fibronectin receptor)をはじめとするいくつかのintegrinが、G-CSFの産生誘導に関与していることがわかった。また、fibronectinをプレートに固相化せず溶液状で細胞に加えた場合や、fibronectinと接着させた培養上清を添加した場合にはG-CSF誘導は観察されず、ECMへの細胞接着が、直接G-CSFの産生誘導を引き起こすことが明らかになった。また、ストローマの場合にも、固相化したcollagenやfibronectinとの接着により、G-CSF誘導が誘起され、ストローマにもマクロファージと同様にECMで活性化される機構が存在することがわかった。 一方、造血組織において、未熟な血球前駆細胞が、造血支持細胞(ストローマ、マクロファージ)と直接相互作用することで、必要な造血サイトカインを産生させ、それによって血球細胞が増殖・分化する現象が報告されている。G-CSF依存性pre-B細胞であるNFS-60は、以前、ストローマと共培養すると、ストローマのG-CSF産生を高めることが報告されていた。そこで、このNFS-60細胞を用いて、細胞接着によるG-CSF産生誘導について解析した。マクロファージについてはNFS-60がG-CSF産生を誘起できるか全く明らかでなかったが、共培養したところ、非常に顕著にG-CSF産生が誘導されることを発見した。マクロファージとの接触を膜で仕切って阻害するとG-CSF誘導がおこらないこと、NFS-60の膜画分のみでG-CSFを誘導できること、NFS-60をtrypsin処理するとG-CSF誘導活性が消失することから、細胞-細胞間の直接の接触がG-CSF産生に必須であり、細胞膜上に存在するある特定のタンパク質がG-CSF inducerとして機能していると考えられた。興味深いことに、NFS-60の亜株で、G-CSF依存性を失い、M-CSFに依存性が変わった変異株、M-NFS-60では全くG-CSFはおこらず、変異をおこしている分子がG-CSF inducerそのものである可能性が高い。NFS-60細胞によるG-CSF誘導はいくつかのintegrin抗体によって阻害されたことより、ここでもintegrinの関与が示唆されたが、NFS-60にはあって、M-NFS-60にはない、G-CSF inducerの正体は未解明のままである。また、スロトーマ系のST-2 cl.11を用いた場合にも、NFS-60によるG-CSF誘導が確認され、細胞-細胞間接着の場合にもマクロファージとストローマに共通のG-CSF誘導機構の存在が示唆された。 (3)G-CSF誘導アゴニスト抗体の作製 マクロファージ系細胞の表面に存在する未知のG-CSF inducer受容体を同定するために、マクロファージ細胞膜表面を認識するモノクローナル抗体のライブラリーの中からG-CSF誘導活性を有するアゴニスト抗体を選抜し、その抗体と抗原(G-CSF inducer受容体)の性状を解析するアプローチをおこなった。 免疫原として、RAW264.7細胞を用い、免疫動物として、MRL/MPJ-lpr/lpr自己免疫疾患マウスを用いて、常法に従ってハイブリドーマを作製し、その中からG-CSFの誘導活性を持つ抗体を7クローン取得した。得られた抗体の中でG-CSFの誘導活性の最も高かった3-4H7抗体について、以降の解析をおこなった。 3-4H7抗体は60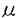 g/mlまで、ほぼ濃度依存的にマクロファージのG-CSF産生を上昇させ、また、刺激8時間後くらいにピークがある誘導パターンを示した。本抗体は、TNF- g/mlまで、ほぼ濃度依存的にマクロファージのG-CSF産生を上昇させ、また、刺激8時間後くらいにピークがある誘導パターンを示した。本抗体は、TNF-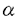 、IL-6、IL-1 、IL-6、IL-1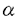 、IL-1 、IL-1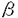 をほとんど誘導せず、他の誘導刺激(LPS、NFS-60細胞、fibronectin、vitronectinなど)と比べてG-CSFに対する誘導特異性が高いこと、また、チオグリコレート誘導腹腔滲出マクロファージに対してもG-CSF誘導活性が認められたことより、in vivoの細胞にも作用しうるという実用上有益な特徴を有することがわかった。 をほとんど誘導せず、他の誘導刺激(LPS、NFS-60細胞、fibronectin、vitronectinなど)と比べてG-CSFに対する誘導特異性が高いこと、また、チオグリコレート誘導腹腔滲出マクロファージに対してもG-CSF誘導活性が認められたことより、in vivoの細胞にも作用しうるという実用上有益な特徴を有することがわかった。 本抗体の認識する分子は、フローサイトメトリー解析の結果、チオグリコレート誘導腹腔滲出マクロファージ、RAW264.7、J774.1、PU5-1.8などのマクロファージ系細胞の他、G-CSF産生細胞ではない、ミエローマ細胞であるPAIや、pre-B細胞系のNFS-60にも発現していた。また、HL-60細胞をマクロファージ系に分化誘導させると3-4H7の抗原が出現することから、ヒトにもマウスと同様の抗原(G-CSF inducer受容体)が存在することが示唆された。 (4)G-CSF誘導アゴニスト抗体の抗原分子の解析 本抗体の抗原分子を同定する目的で、RAW264.7細胞のcDNAを大腸菌に発現させ、3-4H7抗体をプローブとしてイムノスクリーニングをおこなった。その結果、241個の新規アミノ酸配列をコードする827bpのcDNAのクローンを得た。この配列中には明確なシグナル配列、膜貫通領域は観察されなかったので、推定配列よりN末端側2箇所、C末端側1箇所、計3個のペプチドに対してポリクローナル抗体を作製し、各ペプチド抗体とRAW264.7細胞との反応性をFACSを用いて解析した。その結果、N末端側で作製した2つのペプチド抗体は反応したが、C末端側のものは反応せず、細胞膜上ではN末端側を細胞外に、C末端側を細胞内に向けた1回膜貫通型タンパク質の形で分布しているものと考えられた。3種のペプチド抗体は、Western blottingで3-4H7と同様の約30kDaのバンドを認識することより、得られた配列の分子は3-4H7の標的分子であると考えられる。細胞外に結合できる2つのペプチド抗体が、G-CSF誘導活性を示したことから、この分子がG-CSF誘導刺激を伝える受容体である可能性が強く示唆された。 以上、マクロファージにG-CSF産生誘導を引き起こす経路として、細胞外マトリクス分子との接着による経路、inducer細胞との接着による経路、アゴニスト抗体による経路の3種の経路の存在を本研究で明らかにした。これらの経路が全く独立のものであるか、一部共通の機構を含むのかは今のところ不明であるか、少なくともアゴニスト抗体については、その標的分子が未知のタンパク質であることを明らかにすることができた。本研究によって、G-CSFの誘導機構について、細胞接着依存的な誘導という新たな一面を切り開くことができた。また、生体内において、現行の"G-CSF血中投与"に代わる"G-CSFの誘導因子としてのアゴニスト抗体投与"という新しい治療形態の可能性を示した。 |