学位論文要旨
| No | 216779 | |
| 著者(漢字) | 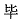 ,秀 ,秀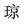 | |
| 著者(英字) | Xiuqiong,Bi | |
| 著者(カナ) | ビー,シュウチョン | |
| 標題(和) | 抗HIV-1治療中及び中断後血漿及び末梢血単核球中の薬剤耐性ウイルスの動態に関する研究 | |
| 標題(洋) | Changes of HIV-1 Resistance-Associated Mutations in Plasma and PBMC during on - Therapy and after Interruption | |
| 報告番号 | 216779 | |
| 報告番号 | 乙16779 | |
| 学位授与日 | 2007.04.25 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第16779号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 【背景】HIV-1(Human immunodeficiency virus type-1)はエイズ(後天性免疫不全症候群, AIDS)の病原ウイルスである。HIV-1はCD4陽性細胞に感染、逆転写後プロウイルスとして宿主細胞のDNAに挿入、その後RNAとして複製するライフサイクルを持つ。強力な多剤併用療法(HAART、highly active antiretroviral therapy)は体内のウイルスの複製と成熟を抑えることによりウイルス増殖を阻止する。現在一般臨床で使用されているのは、ウイルス逆転写を阻害する逆転写酵素阻害剤(RTI)とウイルス粒子の成熟を阻害するプロテアーゼ阻害剤(PI)である。HIV-1はレトロウイルスであり、逆転写の精度が低く、ウイルスの増殖が速いため高変異性を持つ。これが薬剤耐性の原因である。耐性変異は一次変異(major, primary mutation)と二次変異(minor, secondary mutation)に分れ、一次変異がウイルスに耐性を付与すると同時にウイルスの増殖能を低下させ、二次変異は耐性レベルを押し上げて低下した増殖能を引き戻す。HAART失敗時に、血漿を用いて薬剤耐性検査が薦められている。しかし、薬剤耐性ウイルスの動態は血漿と末梢血単核球でどの程度異なるかは示されていない。本研究では、HAART失敗時とHAART中断後の血漿中のHIV-1 RNAウイルスと末梢血単核球中のDNAプロウイルスの耐性変異の動態を解析し、耐性検査はいつ、どの検体で行うのが一番有用な情報を寄与するのかを検討した。 【方法】 本研究では、薬剤耐性遺伝子解析法(genotypic assay)を用いて、PIを含むHAARTを開始後治療が失敗し、血中HIVウイルス量(viral load, VL)が400 copies/ml以上の患者22名の血漿275検体及び末梢血単核球211検体のプロテアーゼ遺伝子をシークエンスし、HAART失敗後PI耐性変異の血漿と末梢血単核球での出現頻度、出現時期、耐性の入り方、またその出現とVLの関連について解析した。また、HAART中断後、薬剤耐性変異を持つ16名の血漿中ウイルスRNAと末梢血単核球中プロウイルスDNAの逆転写酵素およびプロテアーゼ遺伝子をシークエンスし、RTIとPIの耐性変異が野生型に戻るまで両検体中での消失時期、ハ°ターンを解析した。薬剤耐性変異の判定はIAS-USAの耐性変異表に準じた。 【実験結果】 HAARTが失敗したHIV-1患者22名の血漿サンプル275件と末梢血単核球サンプル211件のうち、同時に採取されたのが107対であった。PIを含むHAARTを開始し、血中ウイルスが検出された状態で服薬を続けた場合、107対のサンプル中70対(65.4%)でのPI耐性変異の数が異なり、末梢血単核球中より血漿中の方が耐性変異を多く認め、VLが低いほど末梢血単核球中の耐性変異数が少なかった(P<0.0004)(表1)。また、薬剤耐性変異の出現時期は血漿中と末梢血単核球中で異なり、耐性変異がまず血漿から検出され、続いて末梢血単核球で検出された。共に耐性変異の数は時間とともに徐々に増加した。血漿中の耐性変異出現から末梢血単核球での出現までのlag timeは平均289日(0-739日)と予想より長かった。さらに、VLが10,000 copies/ml未満の場合、血漿中PI一次耐性変異は末梢血単核球中より平均425日(30-680日)早く検出された。末梢血単核球中変異数と血漿中変異数の比はVLと相関を認めた。また、血漿と末梢血単核球中ではともに一次耐性変異と二次耐性変異の出現の時間差がVLと逆相関関係を認めた。 一方、HAARTを中断した16名の患者を解析した結果、薬剤を中止する前に全例がRTI耐性変異を獲得し、そのうち12名がPI耐性変異も獲得していた。血漿と末梢血単核球ではそれぞれ59個のRTI耐性変異、74個のPI耐性変異を含む133個の耐性変異を認めた。HAARTが奏功しVLが低くなった6名の患者では、副作用などのために治療を中止したが、薬剤を中止した際、中止1ヶ月後にVLが著しく上昇し、その上昇したウイルスは1名を除く、5名で耐性ウイルスであった。HAART中断後の耐性ウイルス保有者をKaplan-Meierで解析すると、50%の患者の薬剤耐性変異は血漿では6.3ヶ月に、末梢血単核球では9.2ヶ月に野生型に戻った。同様に50%のRTI耐性変異及びPI耐性変異は3ヶ月後に血漿から消失し、末梢血単核球中ではRTI耐性変異が6.7ヶ月後、PI耐性変異が5.7ヶ月後に検出されなくなった。RTI耐性変異とPI耐性変異は、双方とも末梢血単核球からよりも血漿から早期に消失した。また、血漿中と末梢血単核球中でもRTI耐性変異よりPI耐性変異の方が速く野生型に戻った(図1)。直接シークエンス法で耐性変異が検出されなかったサンプルをクローニング検査法で解析した結果、601クローン中44クローン(7.3%)は耐性株であった。 【考察】PIを含むHAART失敗後、PI耐性変異はまず血漿で検出され、そのあと末梢血単核球のプロウイルスで検出された。血漿でのPI耐性変異は末梢血単核球より平均289日早く検出された。耐性変異は徐々に出現し、特にVLが低い患者では、末梢血単核球での耐性変異の出現時期が血漿よりも大きな時間差を認めた。したがって、治療失敗時の耐性検査は血漿を用いることが推奨できた。一方、治療中断時に耐性変異を獲得していた患者は、治療中断後は野生型のウイルスの増殖能が耐性株より優れるため、検査上は耐性変異が検出されなくなることが示された。しかし、患者体内から耐性ウイルスが完全に消失しているわけではないので、この様な患者に同じ様な治療を行うと治療は失敗する事になる。したがって、耐性検査の結果を判定する上で治療中断後の耐性ウイルスの動態を知る事は非常に重要である。本研究では、50%の患者の耐性変異は血漿から6ヶ月後に、末梢血単核球から9ヶ月後に直接シークエンス法では検出されなくなった。また、血漿中の耐性変異は末梢血単核球中より速く消失し、血漿中の50%の耐性変異は約3か月後には検出されなくなったが、末梢血単核球の耐性変異の50%は約6ヶ月残存した。したがって、治療をすでに中断してしまっている場合には、耐性検査はなるべく早期に行うことが重要であり、さらにその場合可能であれば、血漿ではなく末梢血単核球を検体として使用できれば、検査結果の信頼度は上昇すると考えられた。 【結語】HAART失敗時は、治療中もしくはHAART中断後可能なかぎり早期に血漿を用い耐性検査を行うことが推奨できた。また、HAARTを中断してしまった場合には、末梢血単核球を用いての耐性検査が施行できれば、より有用な情報が得られると考えられた。 表 1. 血漿と末梢血単核球中のプロテアーゼ阻害剤耐性変異 * Wilcoxon signed rank test 図 1HAART中断後133ヶ所の耐性変異の変化を示すKaplan-Meier曲線。耐性変異は血漿と末梢血単核球中それぞれRTIで59ヶ所、PIで74ヶ所が認められた。 PI耐性変異:血漿対末梢血単核球(P<0.05)、RTI耐性変異:血漿対末梢血単核球(P<0,05)、PI耐性変異対RTI耐性変異(P<0.05)。 | |
| 審査要旨 | 本研究は、薬剤耐性検査を行う時期および適切な検体を明らかにする目的で、抗HIV-1(Human immunodeficiency virus type-1)多剤併用療法(HAART、highly active antiretroviral therapy)中に生じる薬剤耐性ウイルスの動態を、HAART失敗時とHAART中断後について、血漿中のHIV-1 RNAウイルスと末梢血単核球中のDNAプロウイルスの耐性変異の変化をそれぞれ解析し、下記の結果を得ている。 1.プロテアーゼ阻害剤(PI)を含むHAARTが失敗したHIV-1患者から同時に採取された血漿中と末梢血単核球中でのPI耐性変異の数は異なり、末梢血単核球中より血漿中の耐性変異の数の方が多かった。この傾向は血中HIVウイルス量(viral load, VL)が低いほど顕著であった。薬剤耐性変異の出現時期は、血漿中と末梢血単核球中で異なり、まず血漿に出現し、続いて末梢血単核球から検出された。また、耐性変異の数はどちらの検体においても時間の経過と共に増加することが示された。本研究では、PI耐性変異の血漿中への出現から末梢血単核球への出現までのlag timeは平均289日(0-739日)であり、特に血漿中PI一次耐性変異出現はVLが10,000 copies/ml未満の場合、末梢血単核球中より平均425日(30-680日)早く検出された。末梢血単核球中変異数と血漿中変異数の比はVLと相関を認めた。以上の結果から、治療失敗時の耐性検査には血漿を用いることが推奨された。 2.薬剤耐性ウイルスを保有する患者がHAARTを中断した場合、耐性ウイルスは野生型に戻る。本研究では、50%の患者の薬剤耐性変異が野生型に戻るまでの期間は、血漿では6.3ヶ月後、末梢血単核球では9.2ヶ月後であった。また、血漿では50%の逆転写酵素阻害剤(RTI)耐性変異及びPI耐性変異は3ヶ月後に、末梢血単核球中ではRTI耐性変異は6.7ヶ月後、PI耐性変異は5.7ヶ月後に検出されなくなることを示した。さらに、RTI耐性変異とPI耐性変異は、ともに末梢血単核球より血漿から早期に消失し、野生型に戻ることを示した。したがって、治療中断後の耐性検査においては、末梢血単核球での検査が可能な場合、検査結果の信頼度は上昇すると考えられた。 3.HAARTを中断した患者の中から、直接シークエンス法で耐性変異が野生型に戻った検体をクローニングで解析した結果、7.3%のクローンは耐性株であり、耐性変異部位の異なる耐性クローンが多く存在することが示された。変異場所が異なる場合ウイルス増殖能は異なる事がある。こと事が治療中断後の耐性ウイルスの複雑な変化に影響していたと考えられた。 以上、本論文は、HAART失敗及び中断後の血漿及び末梢血単核球中の耐性ウイルスの変化の解析から、HAART失敗時には、治療中もしくはHAART中断後可能なかぎり早期に血漿を用い耐性検査を行い、HAARTを中断している場合には、末梢血単核球を用いて耐性検査を行うことが推奨できる事を示した。本研究は、抗HIV治療を行う上で重要な薬剤耐性検査の問題に関し、治療失敗時および治療中断後の耐性検査の時期および検体の選択方法を示し、より良い抗HIV治療の遂行に大きな貢献をなすと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク |