学位論文要旨
| No | 126933 | |
| 著者(漢字) | 尾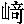 ,依 ,依 | |
| 著者(英字) | ||
| 著者(カナ) | オザキ,ヨリ | |
| 標題(和) | シオミズツボワムシBrachionus plicatilisのインスリン様シグナル伝達経路に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 126933 | |
| 報告番号 | 甲26933 | |
| 学位授与日 | 2011.03.24 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 博農第3686号 | |
| 研究科 | 農学生命科学研究科 | |
| 専攻 | 水圏生物科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | シオミズツボワムシBrachionus plicatilis (以下ワムシと略記)は水産養殖魚の初期餌料として不可欠な動物プランクトンであるが、培養中しばしば増殖不良や個体群の急激な減少が生じることが問題とされてきた。これまでの研究で、寿命、産仔数およびストレス耐性の変化が培養中に生じる個体群の崩壊と関連することが示唆されている。すなわち、餌が豊富なときワムシの寿命は短く、かつストレスタンパク質や抗酸化酵素の発現量が減少してストレス耐性が低下する。一方、このときワムシ個体群は急激に増大し、高密度による低酸素や代謝産物の急激な蓄積などのストレスに晒され、結果として個体群の急激な減少が生じると考えられている。インスリン/インスリン様成長因子-1(IGF-1)シグナル(IIS)伝達経路は、多くの生物で寿命とストレス耐性を制御する。IISの下流に位置するホスファチジルイノシトール3-キナーゼ(PI 3-K)の阻害剤を投与したワムシは寿命が延長して酸化ストレス耐性が増大することから、IISの活性化が個体群の崩壊を引き起こす可能性が示されているが、ワムシにおける本経路に関する詳細な知見はない。 本研究はこのような背景の下、ワムシの個体群変動の分子機構の一端を明らかにすることを目的に、まず、ワムシのIIS伝達および関連分子の探索を行った。次に、クローニングしたワムシのインスリン様ペプチド(ILP)およびインスリン/IGF-1受容体(IR)の分子構造を詳細に解析した。さらに、IISの下流に位置する解糖系酵素の発現とカロリー制限(CR)の関係を明らかにしたもので、得られた成果の概要は以下の通りである。 1. IIS伝達分子の探索 単性生殖のみで増殖するワムシ石川株を1/2人工海水中、25℃で約7 x 106細胞/mLの淡水産クロレラChlorella regularisを給餌してバッチ培養した。常に給餌した個体群、約10日間新たな餌を加えずに絶食させた個体群、および絶食後に再給餌し30および120分が経過した個体群(各約250000個体)を集めリン酸緩衝生理食塩水(PBS)中で破砕し、抽出液を調製した。次に、IGF-1感受性のラットL6筋芽細胞を37℃、湿度100%、CO2 5%の条件下にて無血清培地で約14時間培養後、各抽出液を培地に添加して、IIS伝達分子のリン酸化量に及ぼす影響を調べた。IIS伝達は主にMAPキナーゼ(MAPK)経路とPI 3-K経路の2経路に分かれるが、いずれのワムシ抽出液を加えた場合でも、MAPK経路ではMAPKファミリー分子のキナーゼERKのリン酸化量が増大した。このリン酸化量は、絶食および再給餌よりも給餌ワムシの抽出液を加えた場合に多かった。一方、PI 3-K経路ではプロテインキナーゼB(Akt)の基質61および48 kDaタンパク質のリン酸化量が増大した。なお、ERKおよびAkt基質のリン酸化は、それぞれ上流のMAPKKファミリー分子のMEKおよびPI 3-Kの阻害剤で処理した細胞では抑制された。以上の結果から、ワムシ抽出液中にはIGF-1様の成分が含まれ、当該成分の分泌は給餌により促進されることが示唆された。 次に、常に給餌して培養したワムシから界面活性剤デオキシコール酸ナトリウムを含む50mM Tris-HCl(pH 8.0)緩衝液で調製した抽出液を用い、SDS-PAGE後、哺乳類IIS伝達分子に対する市販抗体でイムノブロットを行い、ワムシ中の相同タンパク質の検出を試みた。その結果、ワムシ中にShc、GRB2、リン酸化ERK、リン酸化Aktおよびリン酸化p38 MAPKに対する抗体で認識される成分が認められた。さらに、先述の給餌条件で培養したワムシにつきイムノブロットを行った結果、再給餌ワムシでERK、Akt基質およびp38 MAPKのリン酸化量の増大が明らかとなり、給餌に伴いIISが活性化することが示唆された。 次に、IIS伝達関連分子のcDNAクローニングを試みた。まず、他生物で種々のIIS伝達分子との結合が報告されている14-3-3タンパク質をbaitにした酵母two-hybrid法を用いて、充分給餌したワムシから作成したcDNAライブラリーをスクリーニングした。その結果、rasGAP、G3BPおよびFASをコードするクローンが得られた。一方、公開されている約5万のcDNA断片からなるワムシ発現配列タグ(EST)データベースを自動アノテーションにより解析した結果、Gene OntologyにおいてIIS伝達経路を構成する77個のタンパク質中35個と相同性を示す配列が明らかとなり、本経路がワムシでも保存されていることが示唆された。別途、他生物種のILPおよびIRのアミノ酸配列をプローブにワムシESTデータベースをBLAST検索したところ、相同性を示すcDNA断片が得られた。 2. ILPおよびIRの構造および機能解析 PCRおよびRapid amplification of cDNA ends (RACE)によりワムシILPのcDNA全長598 bpを明らかにした。演繹アミノ酸172残基と他生物種ILPとのアミノ酸同一率は9-13%と低かったが、多様な生物種のILPでジスルフィド結合を形成する6つのシステイン残基は、ワムシILPでもすべて保存されていた。哺乳類インスリンはプロセシングの結果生じる2本のポリペプチドがジスルフィド結合するが、IGF-1は一本鎖ポリペプチドが分子内にジスルフィド結合を形成する。そこで、前述のTris-HCl緩衝液を用いて調製したワムシ抽出液をSDS-PAGEに供し、ILPに対するポリクローナル抗体を用いてイムノブロットを行った。なお、ワムシILP抗体は、Aペプチドに相当する18残基に対して作成した。その結果、還元および非還元条件下でワムシILPの分子量は変化せず、ワムシILPは哺乳類IGF-1と同様に一本鎖ポリペプチドであることが明らかとなった。また、同抗体でワムシ個体の免疫染色を行った結果、輪毛器、側部触手、足部および卵に発現が見られた。 次に、IRのcDNA全長 4146 bpを決定した。演繹アミノ酸 1321残基は他生物種IRのそれと19-24%のアミノ酸同一率を示した。一般に、IRにリガンドが結合すると受容体チロシンキナーゼが活性化してIR bサブユニットが自己リン酸化される。そこで、別途IR bサブユニットを構成する16残基に対して作成したポリクローナル抗体を用いて前節のワムシ抽出液を免疫沈降に供し、抗リン酸化チロシン抗体でイムノブロットを行った。その結果、免疫沈降物はチロシンリン酸化されていることが示された。なお、チロシンリン酸化に及ぼす給餌の影響は認められなかった。 また、上記ILPおよびIRと、その下流のAktのmRNA蓄積量を、卵、給餌した孵化直後および給餌した孵化後約12時間の個体で定量的リアルタイムPCRにより比較した。その結果、いずれの分子も卵のmRNA蓄積量は孵化直後および孵化後約12時間の個体の2.8-22.4倍と有意に高く(p < 0.05)、IISはワムシの発生段階で機能することが示唆された。 3. ワムシ類ILPとIRの分子系統解析 一般に、無脊椎動物は複数のILP遺伝子を含むが、ワムシESTデータベースより単離されたILPは一種類のみである。そこで、ワムシと近縁のB. manjavacasおよび異なる綱のワムシ類Adineta vagaのESTあるいはゲノムデータベースを用いてILPをコードする配列を検索した。その結果、B. manjavacasから1種、A. vagaから3種の配列が得られた。B. manjavacasおよびA. vaga ILPの演繹アミノ酸はいずれもジスルフィド結合の形成に必須な6つのシステイン残基を含み、ワムシILPの相同領域と、それぞれ90および4-7%のアミノ酸同一率を示した。ベイズ法による分子系統解析の結果、ワムシ類ILPは一つのグループを形成し、他生物種ILPとは異なる進化を遂げたと推定された。 一方、一般に無脊椎動物は1種類のIR遺伝子を有する。そこで上記データベースを検索したところ、A. vagaから1種類のIRの部分塩基配列が得られ、その演繹アミノ酸と他生物種の配列も含めた分子系統解析でワムシIRとひとつのグループを形成した。さらに、ワムシIRの全配列を他生物種のものと比較したところ、線虫のホモログであるDAF-2と最も相同性が高かった。 4. 解糖系酵素の発現に及ぼすCRの影響 哺乳類ではIISが減弱すると、転写因子FoxOが活性化して標的遺伝子群の転写を誘導することが知られている。一方、モデル生物の線虫では、解糖系酵素グリセルアルデヒドリン酸デヒドロゲナーゼ(GAPDH)が FoxOのホモログDAF-16の標的とされている。そこでGAPDHのcDNAをワムシからクローニングし、先述のIISを抑制するCRのmRNA蓄積量に及ぼす影響を調べた。毎日約7 x 106細胞/mLの餌を含む新しい培地に移して個別培養する対照区と、1日おきに給餌と絶食を繰り返すCR条件で個別培養した1-8日齢の個体のmRNA蓄積量は、すべての日齢でCR区が対照区の1.7-3.6倍高く、二元配置分散分析でmRNA蓄積量に及ぼすCRの影響は有意と判定された。以上の結果は、ワムシでもGAPDHの発現はIISに制御されていることを示唆する。 バッチ培養したワムシは爆発的に増殖する指数増殖期を経て、個体群が安定する定常期に移行する。定常期個体群は個体あたりの餌の量が少ないCR状態にある一方で、個体密度の増加に伴う低酸素に晒される。そこで、上述したCR区および対照区の3および4日齢のワムシをそれぞれ無給餌、25℃で低酸素(酸素濃度0.1%以下)に11および7.5時間晒し、両区の生残率を比較した。その結果、3日齢の生残率は対照区およびCR区でそれぞれ76および96%、4日齢では60および91%といずれもCR区で有意に高く、CRによりワムシの低酸素耐性が増大することが示された。次に、解糖系酵素エノラーゼ(ENO)およびホスホグルコムターゼ(PGM)のmRNA蓄積量を調べた。その結果、ENOは5日齢の試料でCR区が対照区の0.9倍とわずかに低かったが、それ以外のすべての日齢で1.5-3.0倍高く、統計解析の結果、mRNA蓄積量に及ぼすCRの影響は有意であった。統計的にはPGM mRNA蓄積量に及ぼすCRの影響は有意ではなかったが、CR区は対照区よりも概ね高く、CRによりワムシは嫌気的エネルギー代謝へシフトすると考えられた。さらに、バッチ培養した個体群のGAPDH、ENOおよびPGMのmRNA蓄積量は、定常期で指数増殖期のそれぞれ1.5、2.7および2.9倍で、ENOの値は有意に高く、IISの抑制を介した低酸素耐性の増大が定常期個体群の安定化に寄与する可能性が示された。 以上、本研究ではワムシのIIS伝達および関連分子を網羅的にスクリーニングし、給餌の有無がIIS伝達分子のリン酸化に影響を及ぼすなど、同伝達経路がワムシでもよく保存されていることを示した。また、ILPおよびIRにつき、構造および機能解析を行うとともに、分子系統解析を行って分子進化を考察した。さらに、CRによる解糖系酵素の発現や低酸素耐性に及ぼす影響を調べることにより、IIS伝達の抑制がワムシ個体群の安定化に寄与することを示唆した。これらの成果は、個体群変動の分子機構の解明に寄与するのみでなく、ワムシを初期餌料として多く利用する水産養殖の発展にも資するところが大きいと考えられる。 | |
| 審査要旨 | シオミズツボワムシBrachionus plicatilis(以下ワムシと略記)は水産養殖魚の初期餌料として不可欠な動物プランクトンであるが、培養中しばしば増殖不良や個体群の急激な減少が生じる。IGF-1シグナル(IIS)伝達経路は、多くの生物で寿命とストレス耐性を制御する。IISの下流に位置するPI 3-Kの阻害剤を投与したワムシは寿命が延長して酸化ストレス耐性が増大することから、IISの活性化が個体群の崩壊を引き起こす可能性が示されているが、ワムシにおける本経路に関する詳細な知見はない。本研究はワムシの個体群変動の分子機構の一端を明らかにすることを目的に、ワムシのIIS伝達および関連分子の探索を行うとともに、IISの下流に位置する解糖系酵素の発現とカロリー制限(CR)の関係を明らかにした。 ワムシ石川株を1/2人工海水中、25℃で淡水産クロレラChlorella regularisを給餌してバッチ培養した。常に給餌した個体群、約10日間新たな餌を加えずに絶食させた個体群、および絶食後に再給餌し30および120分が経過した個体群を集めPBS中で破砕し、抽出液を調製した。次に、ラットL6筋芽細胞を無血清培地で約14時間培養後、各抽出液を培地に添加した。IIS伝達は主にMAPK経路とPI 3-K経路の2経路に分かれるが、いずれのワムシ抽出液を加えた場合でも、MAPK経路ではERKのリン酸化量が増大した。このリン酸化量は、絶食および再給餌よりも給餌ワムシの抽出液を加えた場合に多かった。一方、PI 3-K経路ではAktの基質61および48 kDaタンパク質のリン酸化量が増大した。次に、常に給餌して培養したワムシから調製した抽出液を用い、SDS-PAGE後、哺乳類IIS伝達分子に対する市販抗体でイムノブロットを行った。その結果、ワムシ中にShc、GRB2、リン酸化ERK、リン酸化Aktおよびリン酸化p38 MAPKに対する抗体で認識される成分が認められた。さらに、先述の給餌条件で培養したワムシにつきイムノブロットを行った結果、再給餌ワムシでERK、Akt基質およびp38 MAPKのリン酸化量が増大した。 次に、14-3-3タンパク質をbaitにした酵母two-hybrid法を用いて、充分給餌したワムシから作成したcDNAライブラリーをスクリーニングしたところ、rasGAP、G3BPおよびFASをコードするクローンが得られた。ワムシESTデータベースを自動アノテーションにより解析した結果、Gene OntologyにおいてIIS伝達経路を構成する77個のタンパク質中35個と相同性を示す配列が明らかとなった。さらに、PCRおよびRACEによりワムシインスリン様ペプチド(ILP)のcDNA全長598 bpを明らかにした。他生物種ILPとのアミノ酸同一率は9-13%と低かったが、ジスルフィド結合を形成する6つのシステイン残基は保存されていた。さらに、SDS-PAGEおよびイムノブロットで、ワムシILPは一本鎖ポリペプチドであることが示された。また、ワムシ個体の免疫染色を行った結果、輪毛器、側部触手、足部および卵に発現が見られた。 次に、インスリン/IGF-1受容体(IR)のcDNA全長4146 bpを決定したところ、他生物種IRと19-24%のアミノ酸同一率を示した。抗体を用いて前述のワムシ抽出液を免疫沈降に供し、抗リン酸化チロシン抗体でイムノブロットを行ったところ、免疫沈降物はチロシンリン酸化されていることが示された。さらに、ワムシと近縁のB. manjavacasおよび異なる綱のワムシ類Adineta vagaのデータベースを検索して、B. manjavacasから1種、A. vagaから3種のILP配列を得た。B. manjavacasおよびA. vaga ILPはいずれもジスルフィド結合の形成に必須な6つのシステイン残基を含み、ワムシILPの相同領域と、それぞれ90および4-7%のアミノ酸同一率を示した。一方、A. vagaから1種類のIRの部分塩基配列が得られた。 グリセルアルデヒドリン酸デヒドロゲナーゼ(GAPDH)cDNAをワムシからクローニングし、先述のIISを抑制するCRのmRNA蓄積量に及ぼす影響を調べた。毎日餌を含む新しい培地に移して個別培養する対照区と、1日おきに給餌と絶食を繰り返すCR条件で個別培養した1-8日齢の個体のmRNA蓄積量は、すべての日齢でCR区が対照区の1.7-3.6倍高かった。次に、CR区および対照区の3および4日齢のワムシをそれぞれ無給餌、25℃で低酸素に11および7.5時間晒し、両区の生残率を比較した。その結果、3日齢の生残率は対照区およびCR区でそれぞれ76および96%、4日齢では60および91%といずれもCR区で高かった。また、解糖系酵素エノラーゼ(ENO)およびホスホグルコムターゼ(PGM)のmRNA蓄積量を調べた。その結果、ENOは5日齢の試料でCR区が対照区の0.9倍とわずかに低かったが、それ以外のすべての日齢で1.5-3.0倍高く、CRによりワムシは嫌気的エネルギー代謝へシフトすると考えられた。さらに、バッチ培養した個体群のGAPDH、ENOおよびPGMのmRNA蓄積量は、定常期で指数増殖期のそれぞれ1.5、2.7および2.9倍であった。 以上、本研究はワムシのIIS伝達および関連分子を網羅的にスクリーニングし、給餌の有無がIIS伝達分子のリン酸化に影響を及ぼすなど、同伝達経路がワムシでもよく保存されていることを示した。さらに、CRによる解糖系酵素の発現や低酸素耐性に及ぼす影響を調べることにより、IIS伝達の抑制がワムシ個体群の安定化に寄与することを示唆したもので、学術上、応用上資するところが少なくない。よって審査委員一同は本論文が博士(農学)の学位論文として価値あるものと認めた。 | |
| UTokyo Repositoryリンク |